题目内容
【题目】某研究性学习小组设计实验探究元素周期律,如图所示。
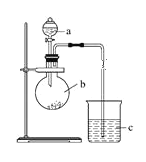
(1)仪器a的名称是____________,加入的药品为稀硝酸;仪器b的名称是____________,加入的药品为碳酸钠固体;b中反应现象为___________,验证氮的非金属性比碳的___(填“强”或“弱”)。
(2)c中装有硅酸钠溶液,c中反应现象为____,验证硅的非金属性比碳的___(填“强”或“弱”)。
(3)结论:同一周期从左到右元素非金属性逐渐____(填“增强”或“减弱”);同一主族从上到下元素非金属性逐渐_______(填“增强”或“减弱”)。
(4)某同学考虑到稀硝酸的挥发,则应在装置b和c之间增加一个盛有_______试剂的洗气瓶。
【答案】分液漏斗 圆底烧瓶 固体溶解 有气泡生成 强 产生白色浑浊弱 增强 减弱 饱和NaHCO3溶液
【解析】
非金属性越强最高价氧化物对应的水化物酸性越强,强酸可以和弱酸盐反应生成相应的弱酸和强酸盐。
(1)根据a的结构特点可知其为分液漏斗;b为圆底烧瓶;硝酸的酸性比碳酸强,所以稀硝酸可以和碳酸钠固体反应生成碳酸,碳酸不稳定分解生成二氧化碳,所以现象为:固体溶解,有气泡生成;说明N的非金属性比C的强;
(2)碳酸酸性比硅酸强,所以二氧化碳进入硅酸钠溶液反应生成硅酸,硅酸不溶于水,所以现象为产生白色浑浊,可验证硅的非金属性比碳弱;
(3)N和C属同一周期,N比C靠右,非金属性N>C,说明同一周期从左到右元素非金属性逐渐增强;Si和C属于同一主族,且C比Si靠上,非金属性C>Si,说明同一主族从上到下元素非金属性逐渐减弱;
(4)硝酸的挥发性会影响实验的准确性,除去二氧化碳气体中混有硝酸可以用饱和碳酸氢钠溶液。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】现有五种元素,其中A、B、C为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C原子第一至第四电离能如下: I1=738 kJ·mol-1,I2=1451 kJ·mol-1,I3=7733 kJ·mol-1,I4=10540 kJ·mol-1 |
F是前四周期中电负性最小的元素 |
G在周期表的第八列 |
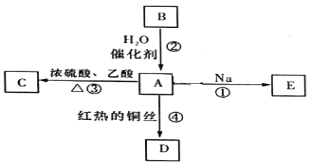
(1)已知BA5为离子化合物,写出其电子式:________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈____形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() ,该同学所画的电子排布图违背了___________________________________。
,该同学所画的电子排布图违背了___________________________________。
(4)G位于第____族____区,该元素的核外电子排布式为_____________________。该二价离子很容易被氧化成三价离子,从原子轨道理论解释原因________________________
(5)检验F元素的方法是___,请用原子结构的知识解释产生此现象的原因: ______。
【题目】A~G是短周期主族元素,原子序数依次增大。它们的部分信息如下表所示:
A | B | C | D | E | F | G | |
原子半径/nm | 0.077 | 0.074 | 0.186 | 0.143 | 0.099 | ||
主要化合价 | -4,+4 | -2 | +3 | -4,+4 | -1,+7 | ||
其它 | 阳离子核外无电子 | 它的化合物数量众多分布极广 | 焰色反应呈黄色 | 无机非金属材料的主角 |
(1)F在元素周期表中的位置是____________;
(2)任写一个BA4的同系物的分子式___________;
(3)请用电子式表示DG的形成过程____________;
(4)元素D与C按原子个数比1∶1形成的化合物所含的化学键有______(填化学键类型);
(5)D与E相比,金属性较强的是_____(用元素符号表示),元素D、E最高价的氧化物对应的水化物反应的离子方程式为___________
(6)工业上冶炼单质E的化学方程式为_______。