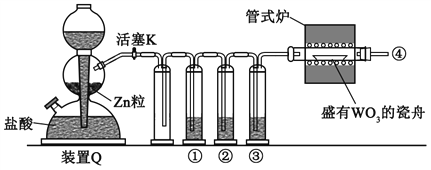
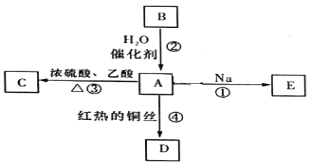
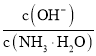题目内容
【题目】(1)下列各组物质
①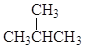 和
和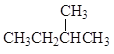 ②
②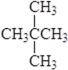 和
和![]() ③CH4和CH3CH2CH3 ④ 金刚石和石墨 ⑤ H、D、T ⑥ 16O、17O、18O ⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3) ⑧臭氧(O3)和氧气(O2)。
③CH4和CH3CH2CH3 ④ 金刚石和石墨 ⑤ H、D、T ⑥ 16O、17O、18O ⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3) ⑧臭氧(O3)和氧气(O2)。
属于同素异形体的是________________;互为同位素的是_________________;
互为同系物的是___________________;互为同分异构体的是_____________。(请将正确的序号填在横线上)
【答案】④⑧ ⑤⑥ ①③ ②⑦
【解析】
同系物是指结构相似、分子组成相差若干个“CH2”原子团的有机化合物;
同分异构体是具有相同分子式而结构不同的化合物;
同素异形体是由同种元素形成的不同单质;
同位素是质子数相同,中子数不同的核素;
①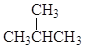 和
和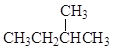 是结构相似、分子组成相1个“CH2”原子团的有机化合物,属于同系物;
是结构相似、分子组成相1个“CH2”原子团的有机化合物,属于同系物;
②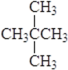 和
和![]() 是具有相同分子式而结构不同的化合物,属于同分异构体;
是具有相同分子式而结构不同的化合物,属于同分异构体;
③CH4和CH3CH2CH3是结构相似、分子组成相2个“CH2”原子团的有机化合物,属于同系物;
④ 金刚石和石墨是由同种元素形成的不同单质,属于同素异形体;
⑤ H、D、T是质子数相同,中子数不同的核素,属于同位素;
⑥ 16O、17O、18O是质子数相同,中子数不同的核素,属于同位素;
⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3)是具有相同分子式而结构不同的化合物,属于同分异构体;
⑧臭氧(O3)和氧气(O2)是由同种元素形成的不同单质,属于同素异形体;
综上所述,属于同素异形体的是④⑧;互为同位素的是⑤⑥;互为同系物的是①③;互为同分异构体的是②⑦。

【题目】现有五种元素,其中A、B、C为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C原子第一至第四电离能如下: I1=738 kJ·mol-1,I2=1451 kJ·mol-1,I3=7733 kJ·mol-1,I4=10540 kJ·mol-1 |
F是前四周期中电负性最小的元素 |
G在周期表的第八列 |
(1)已知BA5为离子化合物,写出其电子式:________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈____形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() ,该同学所画的电子排布图违背了___________________________________。
,该同学所画的电子排布图违背了___________________________________。
(4)G位于第____族____区,该元素的核外电子排布式为_____________________。该二价离子很容易被氧化成三价离子,从原子轨道理论解释原因________________________
(5)检验F元素的方法是___,请用原子结构的知识解释产生此现象的原因: ______。