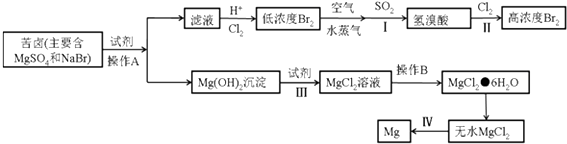
题目内容
【题目】将一定质量的碳酸钠和氢氧化钠的固体混合物完全溶于水,制成180mL稀溶液,然后向该溶液中逐滴加入1 mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:(提示:假设V混=V1+V2)
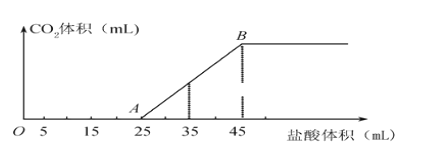
(1)写出OA段所发生反应的化学方程式_____________________,________________________。
(2)当加入35 mL盐酸时,产生CO2的体积为_______________________mL(标准状况)。
(3)原混合物中NaOH的质量为________g。
(4)B点时溶液中钠离子的物质的量浓度为_______________mol·L-1。
【答案】 NaOH+HCl=NaCl+H2O Na2CO3+HCl=NaCl+ NaHCO3 224 0.2 0.2
【解析】(1)溶液中的溶质是氢氧化钠和碳酸钠,首先发生中和反应,则OA段所发生反应的化学方程式依次是NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3。(2)当加入35mL盐酸时与碳酸氢根反应的盐酸体积是35mL-25mL=10mL,盐酸的物质的量是0.01mol,所以根据方程式NaHCO3+HCl=NaCl+H2O+CO2↑可知产生CO2的体积为0.01mol×22.4L/mol=0.224L=224mL。(3)气体体积不再发生变化时,与碳酸氢钠反应的盐酸的体积是20mL,盐酸的物质的量是0.02mol,则碳酸氢钠是0.02mol,因此碳酸钠的物质的量是0.02mol,则与碳酸钠反应消耗盐酸的体积是20mL,因此与氢氧化钠反应的盐酸的体积是5mL,物质的量是0.005mol,则氢氧化钠的质量是0.005mol×40g/mol=0.2g;(4)B点时溶液中溶质是氯化钠,根据氯离子守恒可知氯化钠的物质的量是0.045L×1mol/L=0.045mol,则钠离子的物质的量浓度为0.045mol÷0.225L=0.2mol·L-1。
点晴:明确反应的先后顺序是解答的关键,注意图像题的解答技巧,注意曲线的起点、拐点和终点。另外本题在进行相关计算时要注意利用好守恒法,例如(4)中计算钠离子的浓度时可以利用离子守恒法作答。

【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。

实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是________,FeCl3·6H2O形成白雾的原因是_________(用化学方程式表示)
(2)分析现象ⅰ和ⅱ,推测黄色气体的成分,有以下三种可能:
甲.氯气 乙.氯化铁 丙.既有氯气又有氯化铁
①为检验黄色气体中是否存在氯化铁,应将黄色气体通入______溶液,出现_____(描述现象), 黄色气体中存在氯化铁说明氯化铁具有的性质为__________。结论: 乙或丙成立。
②为进一步确认乙还是丙正确,尚需证明氯气是否存在
方法一:直接检验,检验试剂为_________。
方法二:先除去氯化铁,除杂试剂为___________;再用淀粉碘化钾溶液检验氯气。
(3)实验证明,丙成立。另外,将A中产物分离得到Fe2O3和MnCl2,则A中发生反应的化学方程式是____。
【题目】甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示,下列各组物质中不能按图示关系转化的是
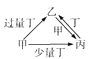
选项 | 甲 | 乙 | 丙 | 丁 |
A | Ca(OH)2 | Ca(HCO3)2 | CaCO3 | CO2 |
B | FeCl3 | Fe | FeCl2 | Zn |
C | Fe | Fe(NO3)2 | Fe(NO3)3 | HNO3 |
D | SO2 | Na2SO3 | NaHSO3 | NaOH |
A. A B. B C. C D. D