题目内容
【题目】我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mgL﹣1 . 其工业提取法有:
(1)空气吹出纯碱吸收法.方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴.该方法涉及的反应有:
①(写出离子方程式);
②3Br2+3CO32﹣═BrO3﹣+5Br﹣+3CO2↑;
③(写出离子方程式);
(2)空气吹出SO2吸收法.该方法基本同(1),只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴.写出溴与二氧化硫反应的化学方程式 .
(3)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢﹣水双温交换法”富集HDO.其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO.如图为“硫化氢﹣水双温交换法”所发生的两个反应中涉及的四种物质在反应体系中的物质的量随温度的变化曲线.写出100℃时所发生的反应的化学方程式;工业上富集HDO的生产过程中,可以循环利用的一种物质是 . 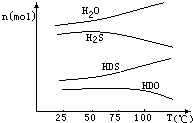
【答案】
(1)Cl2+2Br﹣=Br2+2Cl﹣;BrO3﹣+5Br﹣+6H+═3Br2+3H2O
(2)Br2+SO2+2H2O=4H++SO42﹣+2 Br﹣
(3)H2S+HDO=HDS+H2O;H2S
【解析】解:(1.)①依据题干叙述可知氯气和溴化钠可以置换出溴单质,其化学化学方程式为:Cl2+2NaBr=2NaCl+Br2 , 离子方程式为:Cl2+2Br﹣=Br2+2Cl﹣ , 所以答案是:Cl2+2Br﹣=Br2+2Cl﹣;②溴离子和溴酸根离子用硫酸酸反应,发生氧化还原反应生成单质溴,反应的离子方程式为:BrO3﹣﹣+5Br﹣+6H+═3Br2+3H2O,所以答案是:BrO3﹣+5Br﹣+6H+═3Br2+3H2O;
(2.)溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应生成硫酸和氢溴酸,反应的离子方程式为:Br2+SO2+2H2O=4H++SO42﹣+2 Br﹣ , 所以答案是:Br2+SO2+2H2O=4H++SO42﹣+2 Br﹣;
(3.)物质的量减少的是反应物,增加的是生成物,反应物为H2S,HDO,生成物为HDS,H2O;HDS中的氢原子可以继续与HDO反应,故H2S可循环利用,所以答案是:H2S+HDO=HDS+H2O; H2S.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案