题目内容
【题目】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g)![]() 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=____kJ·mol-1。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.再加入一定量碳 D.反应物气体体积分数增大
(3)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:
CO(g)+2H2(g)![]() CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如图所示。
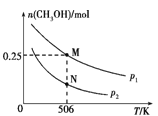
①该反应自发进行的条件是_____________(填“低温”、“高温”或“任意温度”)
②506 K时,反应平衡时H2的转化率为___;压强:p1_____(填“>”“<”或“=”) p2。
③反应速率:N点v正(CO)____(填“>”“<”或“=”)M点v逆(CO)。
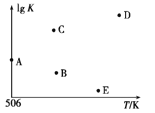
④若压强为p1、在1 L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(lg K)如图所示。则温度为506 K时,平衡常数K=____(保留三位小数),B、C、D、E四点中能正确表示该反应的lg K与T的关系的点为____。
(4)在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和7.4 mol CH3OH(g),在506 K下进行上述反应。为了使该反应逆向进行,a的范围为________。
【答案】-90.1 A 低温 25% > < 0.148 BE 0<a<10
【解析】
(1)根据盖斯定律③/2-①/2得反应②的△H2=(△H3-△H1)/2=-90.1kJ·mol-1。
(2)A.当改变某一条件时,正反应速率先增大后减小,说明开始时平衡逆向移动,后来平衡正向移动,反应物浓度降低导致正反应速率减小,故A项正确;B.化学平衡常数K减少,反应程度减小,所以平衡逆向移动,故B项错误;C .再加入一定量碳,因为C是固体,改变用量,不影响化学平衡移动,故C错误;D.反应物气体体积分数增大,说明平衡逆向移动,故D项错误。综上所述,符合题意的选项为A
(2)①由图分析CO(g)+2H2(g)![]() CH3OH(g)为放热反应,所以自发进行的条件是低温;
CH3OH(g)为放热反应,所以自发进行的条件是低温;
②506 K M点生成0.25mol CH3OH消耗0.5mol H2,H2的转化率为0.5/2=;加压平衡右移,CH3OH的物质的量增大,p1时CH3OH的物质的量较大,所以压强:p1>p2。答案:25%、p1>p2。
③M、N点温度相同,M点压强较大,所以反应速率:N点v正(CO) <M点v逆(CO)。答案:<
④506 K时, CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol·L-1) 1 2 0
转化(mol·L-1) 0.25 0.50 0.25
平衡(mol·L-1) 0.75 1.50 0.25
K=![]() =
=![]() L2·mol-2≈0.148 L2·mol-2。K越大,lgK越大,该反应的正反应是放热反应,升高温度,平衡常数K减小,所以,B、E点符合题意。答案:0.148 BE。
L2·mol-2≈0.148 L2·mol-2。K越大,lgK越大,该反应的正反应是放热反应,升高温度,平衡常数K减小,所以,B、E点符合题意。答案:0.148 BE。
(4)温度不变,平衡常数不变,K=0.148 L2·mol-2。为了使反应逆向进行,必须使Qc>K,即![]() >0.148,解得:a<10,又因为H2的物质的量必须大于0,所以,a的范围为0<a<10。
>0.148,解得:a<10,又因为H2的物质的量必须大于0,所以,a的范围为0<a<10。

 53随堂测系列答案
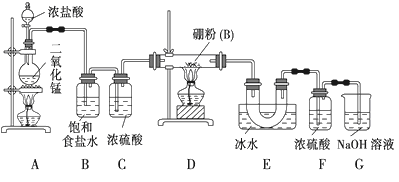
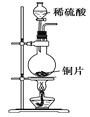
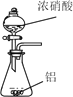
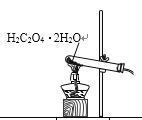
53随堂测系列答案【题目】已知草酸晶体(H2C2O4·2H2O)的熔点为101℃,170℃分解。下列选用的装置和药品能达到实验目的的是
A | B | C | D |
|
|
|
|
制取SO2 | 制取NO2 | H2C2O4·2H2O分解 | 分离苯与溴苯 |
A. A B. B C. C D. D