题目内容
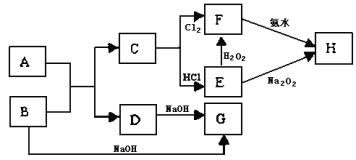
【题目】中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体。
请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围____;
(2)写出H2O2的电子式:____;
(3)写出B→G的离子方程式____;
(4)若A、B恰好完全反应,将产物C与足量盐酸反应得到amol气体,另取等质量B与足量盐酸反应得到b mol气体,a:b=5:7,则A的化学式为___。
【答案】1100nm ![]() 2Al+2OH+2H2O=2AlO2+3H2↑ Fe5O7
2Al+2OH+2H2O=2AlO2+3H2↑ Fe5O7
【解析】
已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体,则H为Fe(OH)3,C+Cl2→F,判断F为FeCl3,C为Fe,E和过氧化氢反应生成F,说明E为FeCl2,转化关系中的B、D都和氢氧化钠反应,A+B=C+D是金属置换铁的置换反应,判断为A为铁氧化物,B为Al,D为Al2O3,G为NaAlO2,结合对应物质的性质以及题目要求解答该题。
(1)胶体粒子直径介于1100nm;
(2)H2O2的电子式为:![]() ;
;
(3)②B→G的反应为铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;反应的离子方程式为2Al+2OH+2H2O=2AlO2+3H2↑;
(4)A、B恰好完全反应后,将产物铁与足量盐酸反应得到a mol气体,根据转移电子守恒知铁的物质的量=氢气的物质的量=amol,若将反应前的铝与足量NaOH溶液反应,可得到b mol气体,2Al→3H2,根据转移电子守恒知铝的物质的量=![]() bmol,且a:b=5:7,设铁的化合价为x,根据转移电子守恒:
bmol,且a:b=5:7,设铁的化合价为x,根据转移电子守恒:![]() b mol×(3-0)= a mol×(x-0),则x=+
b mol×(3-0)= a mol×(x-0),则x=+![]() ,则A的化学式为Fe5O7。
,则A的化学式为Fe5O7。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案