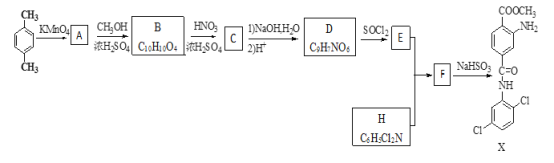
题目内容
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
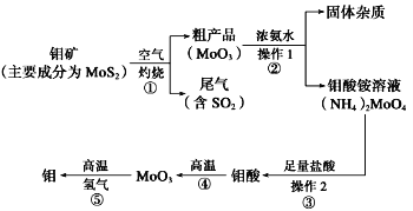
(1)写出在高温下发生反应①的化学方程_____
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:___
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有_____
(4)某同学利用如图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:

①步骤⑤的化学反应方程式为___。请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是____。
②在烧瓶A中加入少量硫酸铜的目的是__
③两次使用D装置,其中所盛的药品依次是_____、____。
【答案】2MoS2+7O2![]() 2MoO3+4SO2 SO2+2NH3·H2O=2NH4++SO32-+ H2O 烧杯、漏斗、玻璃棒 MoO3 +3H2
2MoO3+4SO2 SO2+2NH3·H2O=2NH4++SO32-+ H2O 烧杯、漏斗、玻璃棒 MoO3 +3H2![]() Mo +3H2O ACBDD 可形成原电池,加快生成氢气的速率 无水硫酸铜 碱石灰
Mo +3H2O ACBDD 可形成原电池,加快生成氢气的速率 无水硫酸铜 碱石灰
【解析】
根据流程图分析主要反应和主要操作,完成化学方程式、选择所需仪器。根据实验目的,设计相关实验,并防止空气的影响。
(1)据流程图找出反应①的反应物、生成物,并用化合价升降法配平,得2MoS2+7O2![]() 2MoO3+4SO2;
2MoO3+4SO2;
(2)足量的浓氨水吸收SO2生成正盐,离子方程式为SO2+2NH3·H2O=2NH4++SO32-+ H2O;
(3)步骤②得固体和溶液,操作1为过滤。步骤③复分解反应能进行,则钼酸难溶于水,操作2为过滤。需要使用的主要玻璃仪器有烧杯、漏斗、玻璃棒;
(4)①步骤⑤的化学反应方程式为MoO3 +3H2![]() Mo +3H2O;制备H2并还原MoO3可证明其还原性,用无水硫酸铜检验氧化产物水,必须对氢气干燥,并防止空气中水汽干扰。故装置连接顺序是ACBDD,故答案为:MoO3 +3H2
Mo +3H2O;制备H2并还原MoO3可证明其还原性,用无水硫酸铜检验氧化产物水,必须对氢气干燥,并防止空气中水汽干扰。故装置连接顺序是ACBDD,故答案为:MoO3 +3H2![]() Mo +3H2O;ACBDD;
Mo +3H2O;ACBDD;
②在烧瓶A中加入少量硫酸铜,锌置换出铜,从而形成原电池,加快生成氢气的速率;
③第一次使用D装置,所盛药品为无水硫酸铜,用于检验氧化产物水。第二次使用D装置,所盛药品为碱石灰等,防止空气中的水汽使无水硫酸铜变蓝,故答案为:无水硫酸铜;碱石灰。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案