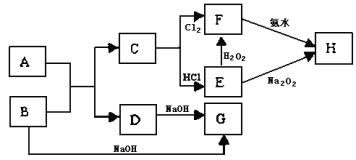
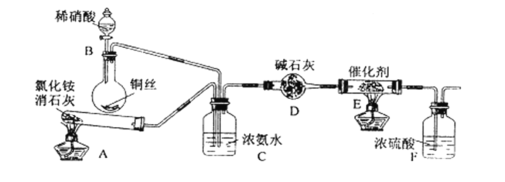
题目内容
【题目】过渡金属元素如Fe、Mn、Cu、Ni可用作很多反应的催化剂,在室温下以H2O2为氧化剂直接将CH4氧化,回答下列问题:
(1)基态铜原子的核外电子排布式是___,第四周期元素中,基态原子未成对电子数最多的元素是____(填元素符号)
(2)C、H、O、Fe四种元素的电负性由大到小的顺序是____
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO等
①CH3OH和HCHO的沸点分别是64.7℃、-19.5℃,其主要原因是____
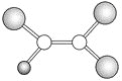
②CH4、HCHO的键角较大的是___,原因是______
(4)Cu2+可与乙二胺(NH2CH2CH2NH2,简写为en)形成配合物,化学式为Cu(en)22+,乙二胺中与Cu2+形成配位键的原子是___(填元素符号),该配合物的配位数是__
(5)Cu晶胞结构如图所示,已知铜原子半径为apm,阿伏加德罗常数用NA表示,则铜晶体的密度为____g/cm3(写出计算表达式)

【答案】[Ar]3d104s1 Cr O、C、H、Fe CH3OH含有分子间氢键 HCHO CH4中C的杂化形式为sp3,键角为109°29′,而HCHO中C的杂化形式为sp2,键角约为120° N 4 ![]() 或
或![]()
【解析】
(1)基态铜原子为第29号元素;第四周期元素中,基态原子未成对电子数最多价电子排布式为3d54s1;
(2)同周期中原子序数越大电负性越强,同主族原子序数越大电负性越小;
(3)①分子间的作用力越强熔沸点越高;
②根据中心原子的杂化方式确定其键角;
(4)乙二胺中的N原子可提供孤电子对,形成配位键,一个乙二胺分子中含有2个N原子,则与铜离子形成4条配位键;
(5)根据铜晶胞的结构,铜原子在晶体的顶点和面心,根据ρ=m/V计算;
(1)基态铜原子为第29号元素,其核外电子排布式是[Ar]3d104s1;第四周期元素中,基态原子未成对电子数最多价电子排布式为3d54s1,为Cr;
(2)同周期中原子序数越大电负性越强,同主族原子序数越大电负性越小,则电负性由大到小的顺序是O、C、H、Fe;
(3)①甲醇分子间存在氢键和分子间作用力,而甲醛分子间只存在分子间作用力,作用力越强熔沸点越高;
②甲烷中C原子的杂化方式为sp3杂化,键角为109°29′,而甲醛中C的杂化方式为sp2杂化,键角为120°;
(4)乙二胺中的N原子可提供孤电子对,形成配位键,一个乙二胺分子中含有2个N原子,则与铜离子形成4条配位键;
(5)根据铜晶胞的结构,铜原子在晶体的顶点和面心,则原子个数为8×1/8+6×1/2=4,面对角线为4a pm,则棱长为2![]() a pm,ρ=m/V=
a pm,ρ=m/V=![]() 或
或![]() 。
。