题目内容
【题目】二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如图:
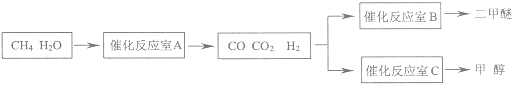
(1)催化反应室B中CO与H2合成二甲醚的化学方程式为___。
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……(Ⅰ)
CO(g)+3H2(g)……(Ⅰ)
CO(g)+H2O(g)![]() CO2(g)+H2(g)……(Ⅱ)
CO2(g)+H2(g)……(Ⅱ)
催化反应室C中发生的反应为:
CO(g)+2H2(g)![]() CH3OH(g)……(Ⅲ)
CH3OH(g)……(Ⅲ)
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率=![]() ×100%。试求反应(Ⅳ)的原子利用率为___。
×100%。试求反应(Ⅳ)的原子利用率为___。
②反应(Ⅳ)的△S___0(填“>”、“=”或“<”)。
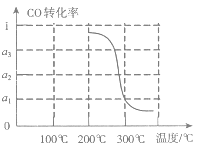
③在压强为5MPa,体积为V L的反应室c中,a mol CO与2a mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如图。则该反应的△H___0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K=___(用含字母的代数式表示)。
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。该燃料电池负极的电极反应式为:CH3OCH3-12e-+16OH-=2CO32-+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入 NaHSO3溶液中得SO2气体回收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下V L的废气,计算消耗二甲醚的质量___。(写出计算过程)
【答案】2CO+4H2=CH3OCH3+H2O 64% < < ![]()
![]() g
g
【解析】
(1)催化反应室B中CO与H2合成二甲醚,由元素守恒可知有水生成,反应方程式为:2CO+4H2=CH3OCH3+H2O;
(2)①由原子利用率定义可知,反应(Ⅳ)的原子利用率=![]() ×100%=
×100%=![]() ×100%=
×100%=![]() ×100%=64%;
×100%=64%;
②反应(Ⅳ)是气体物质的量减小的反应,混乱度减小,故△S<0;
③由图开始,随温度升高,CO的转化率减小,说明升高温度平衡逆向移动,正反应为放热反应,则△H<0;
300℃平衡时CO转化率为α1,则:
CO(g)+2 H2(g)CH3OH(g)
起始量(mol):a 2a 0
变化量(mol):aα1 2aα1 aα1
平衡量(mol):a(1-α1) 2a(1-α1) aα1
平衡常数K=![]() =
=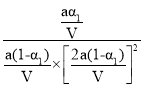 =
=![]() ;
;
(3)含二氧化硫的废气为VL,二氧化硫体积分数为x,则含有二氧化硫体积为Vx L;电解饱和食盐水时阴极电极式为:4H2O+4e-=4OH-+2H2↑,将含SO2的废气通入电解饱和食盐水所得溶液中发生的反应为SO2+ OH-= HSO3-,由整个过程、结合电子转移守恒可得关系式CH3OCH3~12e-~12OH-~12SO2,设消耗二甲醚的质量为m,则:
CH3OCH3~12SO2
46g 12×22.4L
m Vx L
所以m=![]() =
=![]() g。
g。