题目内容
【题目】某校化学研究性学习小组探究足量的镁与浓硫酸反应。回答下列问题:
Ⅰ.甲同学设计如图实验验证该过程产生的混合气体中含有![]() 、
、![]() 。
。
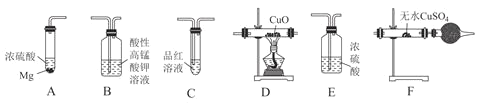
![]() 若按气体从左到右的流向,各装置的连接顺序是________
若按气体从左到右的流向,各装置的连接顺序是________![]() 填字母编号
填字母编号![]() 。
。
![]() 已知装置A中浓硫酸的质量分数为90%,密度ρ=1.47g/mL,该浓硫酸的物质的量浓度为________mol/L。
已知装置A中浓硫酸的质量分数为90%,密度ρ=1.47g/mL,该浓硫酸的物质的量浓度为________mol/L。
![]() 装置C的作用是________。
装置C的作用是________。
![]() 证明混合气体中含有H2的实验现象为________。
证明混合气体中含有H2的实验现象为________。
Ⅱ.乙同学设计如图实验测定混合气体中SO2的含量。

![]() 溶液可以是________
溶液可以是________![]() 填字母
填字母![]() 。
。
![]() 溶液
溶液
![]() 酸性
酸性![]() 溶液
溶液![]() 硫酸酸化
硫酸酸化![]()
![]() 溴水
溴水
![]() 步骤
步骤![]() 中洗涤沉淀的操作为________。
中洗涤沉淀的操作为________。
![]() 通过的混合气体体积为VL(已换算成标准状况)时,该混合气体中二氧化硫的含量
通过的混合气体体积为VL(已换算成标准状况)时,该混合气体中二氧化硫的含量![]() 体积分数
体积分数![]() 为________
为________![]() 用含V、m的代数式表示
用含V、m的代数式表示![]() 。
。
【答案】![]()
![]() 检验
检验![]()
![]() 中黑色CuO变为红色,且F中白色粉末变为蓝色
中黑色CuO变为红色,且F中白色粉末变为蓝色 ![]() 沿玻璃棒向过滤器中加水没过固体,待水滤出后重复操作
沿玻璃棒向过滤器中加水没过固体,待水滤出后重复操作![]() 次
次 ![]()
【解析】
(1)用品红溶液检验SO2,H2具有还原性,用灼热的CuO和无水硫酸铜检验H2,所以先检验SO2并除去SO2、后检验H2,由于溶液中会带出H2O(g),检验H2前应先用浓硫酸除去水蒸气,以免对H2的检验产生干扰,按气流从左至右的顺序为ACBEDF(其他合理答案也给分);
故答案为:ACBEDF(其他合理答案也给分);
(2)![]() ;
;
故答案为:13.5;
(3)装置C的作用是检验SO2;
故答案为:检验SO2;
(4)证明混合气体中含有H2的实验现象为D中黑色物质变为红色,且F中无水CuSO4变为蓝色;
故答案为:D中黑色CuO变为红色,且F中白色粉末变为蓝色;
(5)因酸性KMnO4溶液中含有硫酸,故不可用于二氧化硫的氧化吸收;
故答案为:ac;
(6)步骤③中洗涤BaSO4沉淀,其操作为沿玻璃棒向过滤器中加水没过固体,待水滤出后重复操作2~3次;
故答案为:沿玻璃棒向过滤器中加水没过固体,待水滤出后重复操作2~3次;
(7)根据SO2~BaSO4计算可得![]() ,该混合气体中二氧化硫的含量(体积分数)为
,该混合气体中二氧化硫的含量(体积分数)为![]() ;
;
故答案为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是 ( )
选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
A | SO2 | sp | 直线形 | 直线形 |
B | H2O | sp2 | 平面三角形 | V形 |
C | NH3 | sp2 | 三角锥形 | 三角锥形 |
D | CH4 | sp3 | 正四面体形 | 正四面体形 |
A.AB.BC.CD.D