题目内容
(10分)A、B、C、D、E、F为短周期主族元素,原子序数依次增大,A是相对原子质量最小的元素;D的+1价阳离子与氖原子具有相同的电子层结构;C和E同主族,C和E的原子序数之和是A和D的原子序数之和的2倍;B和C为同周期元素,B的最高价氧化物对应的水化物是一种强酸。请根据以上信息回答下列问题。
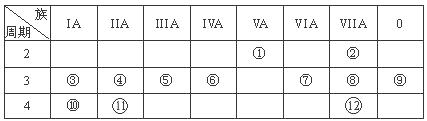
(1)F元素在元素周期表中的位置是______________。
(2)B的氢化物的水溶液呈碱性,用离子方程式表示原因:______________。
(3)A2C2可以制备C2,该反应的化学方程式是______________。
(4)A、B、C 三种元素形成的既含离子键又含共价键的化合物的化学式是___________。
(5)E的单质和E的最高价含氧酸的浓溶液加热发生反应,该反应的化学方程式是______________。
(1)第三周期VIIA族;(2)NH3·H2O NH4++OH-;(3)2H2O2
NH4++OH-;(3)2H2O2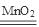 2H2O+O2↑;(4)NH4NO3
2H2O+O2↑;(4)NH4NO3
(5)S+2H2SO4(浓) 3SO2↑+2H2O
3SO2↑+2H2O
解析试题分析:根据题意可推知:A是H;B是N;C是O;D是Na;E是S;F是Cl。(1)F元素在元素周期表中的位置是第三周期VIIA族;(2)B的氢化物的水溶液呈碱性的原因是NH3·H2O NH4++OH-;(3)H2CO2在MnO2作催化剂时发生分解反应可以制备O2,该反应的化学方程式是2H2O2
NH4++OH-;(3)H2CO2在MnO2作催化剂时发生分解反应可以制备O2,该反应的化学方程式是2H2O2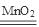 2H2O+O2↑;(4)A、B、C 三种元素形成的既含离子键又含共价键的化合物的化学式是NH4NO3。(5)E的单质和E的最高价含氧酸的浓溶液加热发生反应,该反应的化学方程式是S+2H2SO4(浓)
2H2O+O2↑;(4)A、B、C 三种元素形成的既含离子键又含共价键的化合物的化学式是NH4NO3。(5)E的单质和E的最高价含氧酸的浓溶液加热发生反应,该反应的化学方程式是S+2H2SO4(浓) 3SO2↑+2H2O。
3SO2↑+2H2O。
考点:考查元素的推断、元素在周期表中中的位置、物质的性质、化学方程式、电离方程式的书写的知识。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是( )
| | | X |
| | Y | |
| Z | | |
A.X,Y,Z中X的单质最稳定 B.Y的氢化物为HY
C.X能生成HXO D.能发生Cl2+H2Z=Z+2HCl的反应
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
| A.原子半径的大小顺序: Y<Z<W<X |
| B.化合物YX、ZX2、WX3中化学键的类型相同 |
| C.非金属性的强弱顺序:X>W>Z |
| D.元素W的最高价氧化物对应水化物的酸性比Z的弱 |
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑤ | | ⑥ | | |
| 3 | ① | ③ | ④ | | | | ⑦ | ⑨ |
| 4 | ② | | | | | | ⑧ | |
(2)在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是 (填化学式)。
(3)①、②、③三种元素按离子半径由大到小的顺序依次为 (填离子符号)。
(4)⑥元素形成的具有强氧化性的氢化物结构式是 , 该元素另一种氢化物在常温下与②发生反应的化学方程式为 。