题目内容
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大。已知五种元素中只有一种为金属元素, XW2是通常呈液态的有机物,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为1,次外层电子数等于Y和W2 - 最外层电子数之和。根据以上信息回答下列问题:(用元素符号或化学式等化学用语回答)
(1)XW2的电子式为 。
(2)Y原子中电子运动状态有 种, Z的气态氢化物在同主族元素气态氢化物中最高是因为 。
(3)Q在周期表中的位置 ,其基态原子简化电子排布式为 。交警可以用H2SO4酸化的K2 Cr2O7溶液检测驾驶员是否酒驾,其产物为乙酸、Q3+等。
请写出此原理的离子方程式 。
(4)含W的两种元素种类相同的酸式铵盐溶液反应的离子方程式
。
(5)某种燃料电池一极通乙醇的最简单同系物蒸气,一极通Z2,以NaOH溶液为电解液。请写出该原电池负极的电极反应式 。
(1) 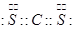
(2) 7 H2O分子间易形成氢键
(3)第四周期 第VIB族 [Ar]3d54s1
2Cr2O72—+3C2H5OH+16H+=4Cr3++3CH3COOH+11H2O
(4)H++HSO3―=H2O+SO2↑
(5)CH3OH—6e—+8OH—=CO32—+6H2O
解析试题分析: 据题意五种元素中只有一种为金属元素,Q的最外层电子数为1可知Q为金属元素。再有XW2是通常呈液态的有机物可联想到CS2故X为碳,W为硫。元素W的原子序数等于元素Z的原子序数加8,可知Z的原子序数为8,即Z为氧元素。再由交警可以用H2SO4酸化的K2Q2O7溶液检测驾驶员是否酒驾,其产物为乙酸、Q3+等。可知Q为Cr元素。Q的最外层电子数为1,次外层电子数等于Y和W2 - 最外层电子数之和,铬的次外层电子数为13,可知Y的最外层电子数为5.所以Y为氮元素。
考点:考查元素周期表的相关知识点。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下列叙述中,正确的是 ( )
| A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
| B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 |
| C.两原子,如果核外电子排布相同,则一定属于同种元素 |
| D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
英国化学家戴维(Davy)用电解法成功地制出了金属钾和钠。他临终前在医院养病期间,一位朋友去看他,问他一生中最伟大的发现是什么,他绝口未提自己发现的众多化学元素中的任何一个,却说:“我最大的发现是一个人——法拉第!”钠(Na)在周期表中的位置是
| A.第二周期第IA族 | B.第二周期第IIA族 |
| C.第三周期第IA族 | D.第三周期第IIA族 |
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
| A.原子半径的大小顺序: Y<Z<W<X |
| B.化合物YX、ZX2、WX3中化学键的类型相同 |
| C.非金属性的强弱顺序:X>W>Z |
| D.元素W的最高价氧化物对应水化物的酸性比Z的弱 |
(14分)下图是元素周期表的一部分
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | | |
| ⑥ | | | | | | | | | | | | ⑦ | | | | ⑧ | |
| | | | ⑨ | | | | ⑩ | | | | | | | | | | |
(2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是 。
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式 。
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是 (填“s”、“p”、“d”、“ds”等)区元素,位于 族;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为 。