题目内容
17.用NA表示阿伏加德罗常数,下列说法中正确的是( )| A. | 某个氯原子的质量为ag,则氯元素的相对原子质量一定是aNA | |
| B. | 标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| C. | 标准状况下,11.2LCCl4所含的原子总数为2.5NA | |
| D. | 10mL98%的浓H2SO4用水稀释至100mL,H2SO4的质量分数为9.8% |
分析 A、氯元素存在同位素,某个氯原子的质量为a g,则氯元素的相对原子质量不一定是aNA;
B、标况下,任何混合气体的体积约为22.4L,CO、C2H4的摩尔质量都是28g/mol;
C、标况下,三氯甲烷不是气体,无法计算其物质的量;
D、硫酸密度大于水,稀释后质量分数会大于9.8%.
解答 解:A、由于氯元素存在同位素,某个氯原子的质量为a g,则氯元素的相对原子质量不一定是aNA,故A错误;
B、标准状况下,分子数为NA的CO、C2H4混合气体物质的量是1mol,体积约为22.4L,质量为28g,故B正确;
C、标准状况下四氯甲烷不是气体,无法计算四氯甲烷的物质的量,故C错误;
D、10mL 98%的浓H2SO4用水稀释至100mL,硫酸密度大于水,H2SO4的质量分数大于9.8%,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数,注意浓硫酸的稀释,稀释后质量分数大于平均质量分数,本题难度不大.

练习册系列答案
相关题目
8.下列是四种烷烃分子的结构模型图,其中沸点最高的是( )
| A. |  | B. | 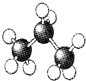 | C. | 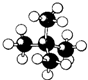 | D. | 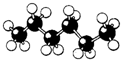 |
12.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率为0.8mol•L-1•s-1,是指在1s时某物质的浓度是0.8mol•L-1 | |
| B. | 化学反应速率是指在一段时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加 | |
| C. | 化学反应速率可以衡量化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应速率越快,反应现象越明显 |
9.如图1所示装置实验,若图2中X 轴表示流入阴极的电子的物质的量,则Y 轴可表示( )
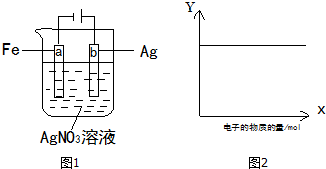
①c(Ag+) ②a棒的质量 ③c(NO3-) ④b棒的质量 ⑤溶液的pH.

①c(Ag+) ②a棒的质量 ③c(NO3-) ④b棒的质量 ⑤溶液的pH.
| A. | ①③ | B. | ③④ | C. | ①②④ | D. | ①③⑤ |
6.25℃时,几种弱酸的电离常数如表:25℃时,下列说法正确的是( )
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| C. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
7.下列关于自发反应说法正确的是( )
| A. | 一定是熵增反应 | |
| B. | 一定是焓减反应 | |
| C. | 一定是△G<0 | |
| D. | 不一定会自动进行,当给予合适条件时会自动进行 |