题目内容
一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1 ℃ | T2 ℃ | T1 ℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)="0.1" mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)="0.4" mol,则T1< T2
AB
解析试题分析:A、正确;B、由图像判断若甲丙为等效平衡,则并的体积为0.5L(丙中浓度均增大一倍),但丙中量增大,压强增大,平衡逆向移动,故需要更小的体积才行,正确;
C、 C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
始量 2
转化量 1.5 1.5 1.5
平衡量 0.5 1.5 1.5
K=" 1.5" ×1.5÷0.5=4.5,错误;
D、甲平衡时水的物质的量为0.5×0.5=0.25mol,该反应为吸热反应,温度高平衡正向移动,水的量变小k值变大,故T2< T1,错误。
考点:考查化学平衡有关问题。

浅绿色的Fe(NO3)2溶液中存在着如下的平衡:Fe2++2H2O Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为( )
Fe(OH)2+2H+若在此溶液中加入稀硫酸,则溶液的颜色变化为( )
| A.绿色变深 | B.浅绿色变得更浅 | C.变黄 | D.无明显变化 |
把下列四种x的溶液,分别加入盛有10 mL、2 mol/L的盐酸的烧杯中,并均加水稀释至50mL,此时x和盐酸缓和地进行反应,其中反应速率最大的是:
| A.20 mL,2 mol/L | B.20 mL,3 mol/L | C.10 mL,5 mol/L | D.10 mL,3 mol/L |
在密闭容器中存在下列平衡:CO(g)+H2O(g)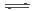 CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。下列说法错误的是
CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。下列说法错误的是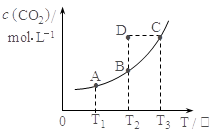
| A.平衡状态A与C相比,平衡状态A的c(CO)小 |
| B.在T2时,若反应处于状态D,则一定有V正<V逆 |
C.反应CO(g)+H2O(g)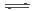 CO2(g)+H2(g) 的ΔH>0 CO2(g)+H2(g) 的ΔH>0 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
对于反应aA+bB=dD+eE,该化学反应速率定义为 。式中
。式中 指物质
指物质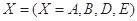 的反应速率,
的反应速率,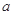 、
、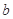 、
、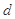 、
、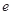 是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
| 实验编号 | 1 | 2 | 3 | 4 |
| c(HI)/ mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 |
| c(H2O2)/ mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 |
| v/ mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 |
A.实验1、2中,
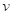 (H2O2)相等
(H2O2)相等B.将浓度均为0.200 mol·L-1H2O2和HI溶液等体积混合,反应开始时
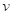 ="0.0304" mol·L-1·s-1
="0.0304" mol·L-1·s-1C.
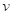 与“HI和H2O2浓度的乘积”的比值为常数
与“HI和H2O2浓度的乘积”的比值为常数D.实验4,反应5秒后H2O2浓度减少了0.0755 mol·L-1
往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g);△H<0,当达到平衡后,t0时改变反应的某一条件,平衡图像如下,则下列说法正确的是
2HI(g);△H<0,当达到平衡后,t0时改变反应的某一条件,平衡图像如下,则下列说法正确的是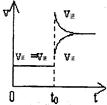
| A.容器内气体颜色变深,平均相对分子质量不变 | B.平衡不移动,混合气体密度增大 |
| C.H2转化率增大,HI平衡浓度变小 | D.t0时改变的条件是增压 |
(6分)(2012?重庆)在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g)?2c(g);△H1<0
x(g)+3y(g)?2z(g);△H2>0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是( )
| A.等压时,通入惰性气体,c的物质的量不变 |
| B.等压时,通入z气体,反应器中温度升高 |
| C.等容时,通入惰性气体,各反应速率不变 |
| D.等容时,通入z气体,y的物质的量浓度增大 |
在密闭容器中进行反应:X(g)+3Y(g)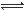 2Z(g),下列说法正确的是 ( )
2Z(g),下列说法正确的是 ( )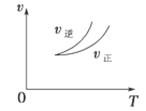
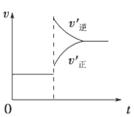
| A.左上图说明正反应为吸热反应 |
| B.反应达平衡后,增大压强气体密度将减小 |
| C.右上图可表示升高温度使平衡向逆反应方向移动 |
| D.右上图虚线可表示使用催化剂后引发的反应速率变化 |
 XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法:
XC(g),经 2 s后反应达平衡,测得 C 的浓度为 0.6 mol·L-1 ,B的物质的量为1.4 mol,现有下列几种说法: