��Ŀ����
����Ŀ��A��B��C��D��E��F���ֶ�����Ԫ�طֱ�λ����������,���ǵ�ԭ��������������A��Dͬ����,B��Eͬ����,C��Fͬ���塣��C��F���γ�ԭ�Ӹ�����Ϊ2��1�Ļ�����M��ԭ�Ӹ�����Ϊ3:1�Ļ�����N����֪EԪ��Ϊ�ؿ��к����ӵ�2λ��Ԫ��,DΪ������
��1��д������Ԫ�ط���:A__________,B__________,C__________,D__________,E__________,F__________��
��2��M����һ������������N,д����Ӧ�Ļ�ѧ����ʽ:__________��
��3��д��F��Ԫ�����ڱ��е�λ��:__________��
��4��д����ҵ����B���Ʊ�����E�Ļ�ѧ����ʽ:__________��
���𰸡�H C O Na Si S 2SO2+O2![]() 2SO3 ��3���ڢ�A�� C+SiO2
2SO3 ��3���ڢ�A�� C+SiO2![]() Si+2CO��
Si+2CO��
��������
A��B��C��D��E��F���ֶ�����Ԫ�طֱ�λ���������ڣ����ǵ�ԭ����������������AΪHԪ�أ�A��Dͬ���壬ԭ������������2����DΪNa��EԪ��Ϊ�ؿ��к����ӵ�2λ��Ԫ�أ���EΪSi��B��Eͬ���壬��BΪ̼Ԫ�أ�C��Fͬ���壬��C��F���γ�ԭ�Ӹ�����Ϊ2��1�Ļ�����M��ԭ�Ӹ�����Ϊ3��1�Ļ�����N����CΪOԪ�ء�FΪSԪ�أ�MΪSO2��NΪSO3���ݴ˽��
(1)A��B��C��D��E��F���ֶ�����Ԫ�طֱ�λ���������ڣ����ǵ�ԭ����������������AΪHԪ�أ�A��Dͬ���壬ԭ������������2����DΪNa��EԪ��Ϊ�ؿ��к����ӵ�2λ��Ԫ�أ���EΪSi��B��Eͬ���壬��BΪ̼Ԫ�أ�C��Fͬ���壬��C��F���γ�ԭ�Ӹ�����Ϊ2��1�Ļ�����M��ԭ�Ӹ�����Ϊ3��1�Ļ�����N����CΪOԪ�ء�FΪSԪ�أ�MΪSO2��NΪSO3��
(2)MΪSO2��NΪSO3��M����һ������������N�Ļ�ѧ����ʽ��2SO2+O2![]() 2SO3��
2SO3��
(3)FΪSԪ�أ��������ڱ��е������ڢ�A�壻
(4)��ҵ����̼�ڸ����»�ԭ���������Ƶþ���Si��������Ӧ�Ļ�ѧ����ʽΪC+SiO2![]() Si+2CO����
Si+2CO����

 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�����Ŀ��ijѧϰС��������ϼӡ�����������β��ȶ��������ֽ⣬�ֽ����������˳���й�)��̽���������ֽ������ǽ�������̽��:
��һ��̽���������
[�������]
���Ƕ��������������²���:
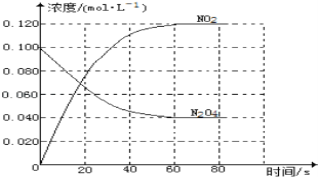
����1:����ΪNO2
����2:����ΪNO��O2
����3:����ΪNO��NO2
����4:����ΪNO2��O2
����5:����ΪNO
��1�����Ǿ������ۣ���Ϊ����2��������������_______������������ԭ��Ӧԭ�����������IJ��뻹��__________
[��������]
�ټ��������۵㡣�е�����:
���� | NO | NO2 | O2 |
�۵�/�� | -163.6 | -11.2 | |
�е�/�� | -151 | 21.1 | -183 |
��2NO2(g) ![]() N2O4(g)(��ɫ) ��H<0
N2O4(g)(��ɫ) ��H<0
[���ʵ��]
����װ��ʡ��(������ȴ���¶�ԼΪ-5��)

ȡһ������ˮ��������������ʵ�飬ʵ����: A��U���ռ�������Һ��������B����ˮ���ռ�һ��������
��2����ʵ�����կ�����ܽӿڴ���������ֽ��������Ŀ����___________
��3��ʵ����ϣ�ȡ��U�ܣ������ӡ��۲쵽����ɫ�����������U���ڵ�������_____
��U�ܼ���_____�����ո����ʡ�������Ⱦ������
��4������Bƿ�ռ�����Ϊ�����IJ���������__________
(��)̽������ɷ�
������������Ԫ�ؼ�̬�������������:��+2�ۢ�+3�ۢ�+2�ۺ�+3�ۡ�
Ϊ��̽����������Ԫ�ؼ�̬���ס���ͬѧ������·�����
���� | ���� | |
�� | ȡ������Ʒ���Թܣ���������ϡ����ʹ������ȫ�ܽ⣬�ٵμ����Ը��������Һ | ��Һ��������ɫ�仯 |
�� | ȡ������Ʒ���Թܣ�����ϡ����ʹ������ȫ�ܽ�,�μ�KSCN��Һ | ��Һ���ɫ |
��5������ʵ�飬����ȷ������ɷֵ�ʵ����______(����������������)����������ʵ����ۡ�д���������ֽⷴӦ�Ļ�ѧ����ʽ______________