题目内容
【题目】(I)无水MgBr2可用作催化剂实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1。

主要步骤如下:
步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。实验中不能用干燥空气代替干燥N2,原因是___________。
(2)如将装置B改为装置C(图2),可能会导致的后果是_______________________。
(3)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(4)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4-=MgY2-
①滴定前润洗滴定管的操作方法是____________________________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
(II)化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4=27H2O+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据__________________、_____________________;
(2)用离子方程式表示除去固体产物中Al2O3的原理________________________________。
【答案】干燥管 防止镁屑与氧气反应,生成MgO杂质 会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患 BD 从滴定管上口加入少量待测液,平斜着缓慢转动滴定管,使液体润湿整支滴管内壁,然后从下口放出,重复2--3次 97.5% 分解反应是吸热反应降温 且生成的氧化镁、氧化铝附着表面隔绝空气,水蒸气稀释空气 Al2O3 +2OH- =2AlO2-+ H2O
【解析】
考查实验方案设计与评价,(I)(1)根据仪器A的特点,仪器A为干燥管;空气中含有氧气,能与金属镁反应生成MgO,不能用干燥空气代替N2的原因是防止镁与氧气反应,生成MgO;(2)因为Mg与液溴反应剧烈放热,因此装置B改为装置C,导致会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患;(3)A、95%的乙醇中含有水,溴化镁有强烈的吸水性,故A错误;B、加入苯的目的是除去乙醚和溴,洗涤晶体用0℃的苯,可以减少产品的溶解,故B正确;C、加热至160℃的主要目的是分解三乙醚合溴化镁得到溴化镁,不是为了除去苯,故C错误;D、该步骤是为了除去乙醚和溴,故D正确;(4)①从滴定管上口加入少量待测液,平斜着缓慢转动滴定管,使液体润湿整支滴管内壁,然后从下口放出,重复2--3次;②根据反应方程式,n(MgBr2)=26.50×10-3×0.05mol=1.325×10-3mol,其质量为1.325×10-3×184g=0.2438g产品的纯度为0.2438/0.2500×100%=97.52%;(II)(1)根据反应方程式,生成氧化镁、氧化铝附着在表面隔绝空气,水蒸气稀释空气,分解反应是吸热反应,可以降温;(2)氧化铝是两性氧化物,氧化镁为碱性氧化物,因此除去氧化铝用NaOH溶液,离子反应是Al2O3+2OH-=2AlO2-+H2O。

【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
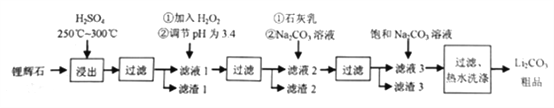
已知:①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量FeO、MgO等。
②Li2O·Al2O3·4SiO2+H2SO4![]() Li2SO4+Al2O3·4SiO2·H2O
Li2SO4+Al2O3·4SiO2·H2O
③某些物质的溶解度(S)如下表所示。
T℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
④Fe3+完全沉淀时pH为3.4
(1)为提高原料浸出速率,除升高温度外还可采取的措施是__________(任写一条)。
(2)在滤液1中加入H2O2的目的是__________(用离子方程式表示);调节pH最佳试剂是__________(填序号 )。
A.CuO B.CuCO3 C.MgO D.NH3·H2O
(3)从滤渣中分离出Al2O3的流程如下图所示,请写出生成沉淀的离子方程式__________。
![]()
(4)向滤液2中加入Na2CO3溶液的作用是__________。
(5)“过滤、热水洗涤”步骤中,“热水洗涤”的原因是__________;证明沉淀已洗净的操作是__________。