题目内容
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度的升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H___0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___molL﹣1s﹣1。
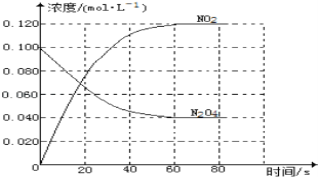
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020molL﹣1s﹣1的平均速率降低,经10s又达到平衡。T___100℃(填“大于”或“小于”),判断理由是_______________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___(填“正反应”或“逆反应”)方向移动。
(4)在2NO2N2O4的可逆反应中,下列状态一定属于平衡状态的是(____)
A.N2O4和NO2的分子数比为1:2 B.N2O4和NO2的浓度相等
C.平衡体系的颜色一定不再改变D.单位时间有1molN2O4变为NO2的同时,有2molNO2变为N2O4
【答案】大于 0.001 大于 正反应方向为吸热反应,改变温度平衡向正反应方向移动逆反应 CD
【解析】
(1)随温度升高,混合气体的颜色变深,二氧化氮的浓度增大,说明平衡向正反应方向移动;升高温度,平衡向吸热反应方向移动,正反应方向是吸热反应,则△H大于0。根据题给图像知,0~60s时段,N2O4的物质的量浓度变化为0.060 mol·L﹣1,根据公式v=△c/△t, v (N2O4)= 0.060 mol·L﹣1÷60s= 0.0010 molL﹣1s﹣1;
(2)改变反应温度为T后,c(N2O4)降低,即平衡向正反应方向移动,又反应正方向吸热,反应向吸热方向进行,故为温度升高,T大于100℃。
(3)温度为T时,反应达平衡,将反应容器的体积减小一半,即增大压强,当其他条件不变时,增大压强,平衡向气体物质平衡向气体物质系数减小的方向移动,即向逆反应方向移动。
(4)A.N2O4和NO2的分子数比为1:2,不能证明反应物和生成物浓度不在发生变化,故A错误; B.N2O4和NO2的浓度相等,不能证明反应物和生成物浓度不在发生变化,故B错误;C.平衡体系的颜色一定不再改变证明反应物和生成物浓度不在发生变化,故C正确;
D.单位时间有1molN2O4变为NO2的同时,有2molNO2变为N2O4,证明反应物和生成物浓度不在发生变化,故D正确;故选CD。