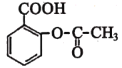
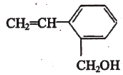
题目内容
【题目】已知化学反应A2(g)+B2(g)═2AB(s)的能量变化如图所示,判断下列叙述中错误的是( )
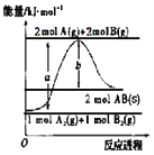
A.该反应热△H=+(a﹣b)kJmol﹣1
B.AB(g)═A2(g)+B2(g)△H=+b/2kJmol﹣1
C.断裂1 mol A﹣A键和1 mol B﹣B键,吸收a kJ能量
D.该反应在任何条件下都不可能自发进行
【答案】B
【解析】
根据反应热公式计算焓变,根据图像信息分析键能,根据吉布斯自由能公式分析反应是否自发进行。
A. 反应热△H=反应物能量总和-生成物能量总和,所以反应热△H=+(a-b)kJmol-1,A正确;
B. 根据化学反应A2(g)+B2(g)═2AB(s)△H=(a-b)kJmol-1,即AB(s) ═A2(g)+B2(g)△H=(b-a)/2kJmol-1, B错误;
C. 由图可知,断裂1 mol A-A和1 mol B-B键,吸收a kJ能量,C正确;
D. 依据反应热知该反应为吸热反应,且反应为熵减的反应,根据吉布斯自由能公式,任何条件下均不能自发进行,D正确;
答案为B。

练习册系列答案
相关题目