题目内容
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
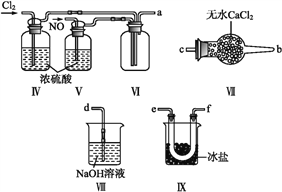
①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
【答案】 浓盐酸 饱和食盐水 稀硝酸 水 e→f(或f→e)→c→b→d 通过观察气泡调节气体的流速 防止水蒸气进入装置Ⅸ中 NOCl+2NaOH=NaCl+NaNO2+H2O HNO3(浓)+3HCl(浓)=NOCl↑+Cl2↑+2H2O
【解析】(1)实验室加热制取氯气是用MnO2与浓盐酸加热生成的,所以分液漏斗中装的是浓盐酸,装置Ⅱ是用于吸收氯气中HCl气体,所以内装饱和的食盐水;实验室里NO是用Cu和稀硝酸反应制取的,所以分液漏斗中装的是稀硝酸,装置Ⅱ是用于吸收NO中HNO3蒸气的,因此内装水即可。
(2)已知NOCl沸点为-5.5 ℃,遇水易水解,所以可用冰盐冷却收集液体NOCl,再用装有无水CaCl2的干燥管Ⅶ防止水蒸气进入装置Ⅸ中使NOCl变质,由于NO和Cl2都有毒且污染环境,所以用NaOH吸收尾气,因此①接口顺序为a→e→f(或f→e) →c→b→d,②通过观察洗气瓶中的气泡的快慢,调节NO、Cl2气体的流速,以达到最佳反应比,提高原料的利用率,减少有害气体的排放,③装置Ⅶ中装有的无水CaCl2,是防止水蒸气进入装置Ⅸ中使生成的NOCl变质,④NOCl遇水反应生成HCl和HNO2,再与NaOH反应,所以反应的化学方程式为:NOCl+2NaOH![]() NaCl+NaNO2+H2O。
NaCl+NaNO2+H2O。
(3)由题中叙述可知,反应物为浓硝酸和浓盐酸,生成物为亚硝酰氯和氯气,所以可写出反应的化学方程式为HNO3(浓)+3HCl(浓)![]() NOCl↑+Cl2↑+2H2O。
NOCl↑+Cl2↑+2H2O。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】除去下列物质中少量杂质所需除杂试剂及方法不正确的是( )
物质(杂质) | 除杂试剂 | 除杂方法 | |
A | 乙醇(水) | CaO | 蒸馏 |
B | 淀粉溶液(NaCl) | ——— | 渗析 |
C | CO2(HCl) | NaOH溶液 | 洗气 |
D | NaCl溶液(I2) | CCl4 | 萃取分液 |
A.A
B.B
C.C
D.D