题目内容
【题目】下图为周期表中短周期的一部分,W、X、Y、Z四种元素最外层电子数之和为24。下列说法正确的是
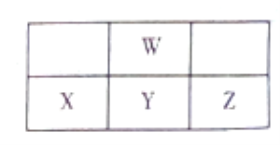
A. X、Y、Z的含氧酸的酸性依次增强
B. W元素形成的单核阴离子还原性强于X
C. Y、W形成的化合物一定能使酸性KMnO4溶液褪色
D. W与氢元素形成的化合物中可能含有非极性键
【答案】D
【解析】
设Y的最外层电子数为n,则W、X、Z的原子序数分别为n、n-1、n+1,则有n+n+n-1+n+1=24,n=6,则W为O元素,X为P元素,Y为S元素,Z为Cl元素,结合原子结构和性质解答。
A.X、Y、Z在同一周期,自左向右,非金属性逐渐增强,非金属性越强,对应的最高价含氧酸酸性越强,但选项中不一定为最高价,故A错误;
B.非金属性W(O)>X(P),元素的非金属性越强,对应的阴离子的还原性越弱,故B错误;
C. O、S形成的化合物有SO2和SO3,SO2具有还原性能使酸性KMnO4溶液褪色,SO3没有还原性不能使酸性KMnO4溶液褪色,故C错误;
D.O与氢元素形成的化合物可能为H2O2,含有非极性键,所以D选项是正确的。
所以D选项是正确的。

【题目】除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是:
混合物 | 试剂 | 分离方法 | |
A | 苯(甲苯) | 溴水 | 分液 |
B | 乙烷(乙烯) | 氢气 | 加热 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
A. A B. B C. C D. D
【题目】五种短周期主族元素W、M、X、X、Z原子序数依次增大,请结合表中信息回答下列问题:
元素 | W | M | X | Y | Z |
结构或性质 | 最高价含氧酸与其气态氢化物能发生化合反应 | 氢化物的水溶液能刻蚀玻璃 | 焰色反应呈火焰黄色 | 同周期主族元素形成的简单离子中,其离子半径最小 | 最高正价与最低负价代数和为6 |
(1)M元素在周期表中的位置为____________。
(2)M、X、Z元素所对应简单离子半径由大到小的顺序为__________(用离子符号表示)。
(3)W最高价含氧酸与其气态氢化物发生化合反应生成的物质中含有的化学键类型为_____。
(4)下列可作为比较M和Z的非金属性强弱的依据是_______(填序号)。
A.单质与H2反应的难易程度 B.氢化物的稳定性
C.最高价氧化物的水化物酸性强弱 D.将M的单质通入Z的钠盐溶液观察是否有Z逸出
(5)常温下,4.6gX单质在空中燃烧,再恢复到常温,放出QkJ能量,该反应的热化学方程式为_______________。
(6)W能形成多种氢化物,其中-种氢化物可作为火箭燃料,该物质中W与氢元素的质量比为7:1,写出该氢化物的电子式___________。该氢化物和O2在碱性条件下可形成燃料电池,产生两种无毒物质,写出其负极的电极反应式____________。
(7)Y元素和W元素形成的化合物YW一种新型无机材料,可与过量烧碱溶液反应产生使湿润的红色石蕊试纸变蓝的气体,写出有关的化学方程式___________________。