题目内容
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)联氨(N2H4)常温下为液态,在空气中迅速完全燃烧生成N2,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
已知:H2(g)+1/2O2(g)==H2O(l);△H1=-285.8kJ/mol
N2(g)+2H2(g)=N2H4(l);△H2=+50.6kJ/mol
则N2H4(l)在空气燃烧生成液态水的热化学方程式为_____________。
(2)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)![]() HCN(g)+3H2(g) △H>0。
HCN(g)+3H2(g) △H>0。
①一定温度下,向2L恒容容器中充入1mol CH4(g)和2mol NH3(g)发生上述反应,4min达到平衡时,测得CH4的转化率为66.67%。0~4min內,用H2表示的该反应速率v(H2)=_____。
保持温度和容积不变,再句平衡后的容器中充入2molNH3和2molH2,此时v正___v逆(选填“>”“<”或“=”)。
②平衡体系中HCN的物质的量(n)随某物理量变化曲线如图所示(图中x、L分别表示温度或压强)。
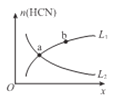
若x为温度,则曲线,____(选填“L1”或“L2”)能正确表示n (HCN) 与温度的关系;
若x为压强,则曲线____(选填“L1”或“L2”)能正确表示n HCN)与压强的关系。
(3)NH3能够形成Ag(NH3)2+。
①溶液中存在Ag+ (aq)+2NH3 (aq)==Ag( NH3)2+(aq )时,其平衡常数的表达式为K稳=_______。
②常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl (s)+2NH3 (aq)![]() Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=_____。
Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=_____。
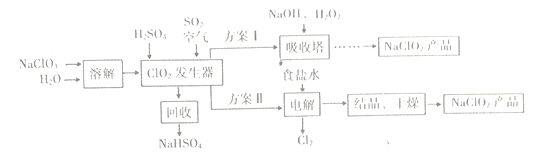
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示发置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
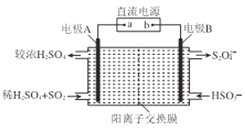
①电极A的电极反应式为______________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体。同时有SO32-生成。该反应离子方程式为______________。
【答案】 N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-622.2kJ/mol 0.25mol/(L·min) < L1 L2 ![]() 1.76×10-10 SO2+2H2O-2e-=SO42-+4H+ 4S2O42-+2NO2+8OH-=8SO32-+N2+4H2O
1.76×10-10 SO2+2H2O-2e-=SO42-+4H+ 4S2O42-+2NO2+8OH-=8SO32-+N2+4H2O
【解析】(1). 已知: ① H2(g)+1/2O2(g)==H2O(l) △H1=-285.8kJ/mol,② N2(g)+2H2(g)=N2H4(l) △H2=+50.6kJ/mol,根据盖斯定律,①×2—②得:N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-622.2kJ/mol,故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-622.2kJ/mol;
(2). ①. 4min达到平衡时,消耗CH4的物质的量为n(CH4)=1mol×66.67%,由反应方程式可知,生成H2的物质的量为n(H2)=3n(CH4)= 1mol×66.67%×3=2mol,则0~4min內,用H2表示的该反应速率v(H2)=2mol÷2L÷4min=0.25mol/(L·min),根据反应方程式及上述计算结果可知,达到平衡时c(CH4)=![]() mol/L、c(NH3)=
mol/L、c(NH3)=![]() mol/L、c(HCN)=
mol/L、c(HCN)=![]() mol/L、c(H2)=1mol/L,则平衡常数K=
mol/L、c(H2)=1mol/L,则平衡常数K=![]() =3,再向平衡后的容器中充入2mo NH3和2molH2,Qc=
=3,再向平衡后的容器中充入2mo NH3和2molH2,Qc=![]() =9.6>K=3,说明v正<v逆,平衡逆向移动,故答案为:0.25mol/(L·min);<;
=9.6>K=3,说明v正<v逆,平衡逆向移动,故答案为:0.25mol/(L·min);<;
② . 该反应为吸热反应,升高温度平衡正向移动,HCN的物质的量增大,则L1能正确表示n(HCN)与温度的关系;该反应为气体分子总数增大的反应,增大压强平衡逆向移动,HCN的物质的量减小,则L2能正确表示n(HCN)与压强的关系,故答案为:L1;L2;
(3). ①. 平衡常数等于生成物平衡浓度的幂之积除以反应物浓度的幂之积,则平衡常数的表达式为:K稳= ![]() ,故答案为:
,故答案为:![]() ;
;
②. Ksp(AgCl)=c(Ag+)×c(Cl-)=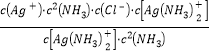 =
=![]() =
=![]() =1.76×10-10,故答案为:1.76×10-10;
=1.76×10-10,故答案为:1.76×10-10;
(4). ①. 由装置图中信息可知电极A为阳极,电极反应式为:SO2+2H2O-2e-=SO42-+4H+,故答案为:SO2+2H2O-2e-=SO42-+4H+;
②. 阴极排出的溶液中含有S2O42-,被NO2氧化为SO32-,根据得失电子守恒和原子守恒,该反应的离子方程式为:4S2O42-+2NO2+8OH-=8SO32-+N2+4H2O,故答案为:4S2O

【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
化学键 | H—O | O=O | N≡N | N—H |
键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是__________________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
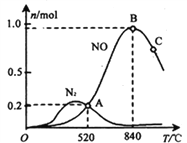
①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有_______________
A.使用催化剂Pt/Ru
B.使用催化剂Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的SO2,
①若氨水与SO2恰好完全反应生成正盐,则此时溶液呈_____性(填“酸”或“碱”)常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10ˉ5mol·Lˉ1;H2SO3 :Ka1=1.3×10ˉ2mol·Lˉ1,Ka2=6.3×10ˉ8mol·Lˉ1
②上述溶液中通入______气体可使溶液呈中性,(填“SO2”或NH3”)此时溶液离子浓度由大到小的顺序_________________________________。