题目内容
【题目】向10mL0.1mol/L二元弱酸H2A溶液中滴加0.1mol/LNaOH溶液,溶液中各组分物质的量分数δ(X) [δ(X)=![]() ]随pH的变化如图所示。下列叙述错误的是
]随pH的变化如图所示。下列叙述错误的是
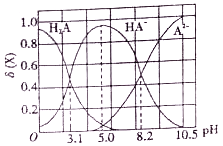
A. Ka1(H2A)为10-3.1
B. pH=5.0时,c(Na+)>c(HA-)>c(H+)>c(OH-)>c(A2-)
C. pH=8.2时,c(Na+)+c(H+)=c(OH-)+3c(A2-)
D. pH由5.0调至10.5时,主要反应的离子方程式为HA-+OH-=A2-+H2O
【答案】B
【解析】A. 由图像可知pH=3.1时,H2A与HA-的曲线相交,则c(H2A)=c(HA-), Ka1(H2A)=![]() = 10-3.1,故A正确;B. pH=5.0时,溶液中的溶质为NaHA,c(H2A)= c(A2-),溶液显酸性,说明HA-的水解程度小于电离程度,水也要电离出部分氢离子,因此c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B错误;C. pH=8.2时,c(HA-)=c(A2-),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+2c(A2-)+ c(HA-)= c(OH-)+3c(A2-),故C正确;D. pH=5.0时,溶液中的溶质为NaHA,pH由5.0调至10.5时,主要反应的离子方程式为HA-+OH-=A2-+H2O,故D正确;故选B。
= 10-3.1,故A正确;B. pH=5.0时,溶液中的溶质为NaHA,c(H2A)= c(A2-),溶液显酸性,说明HA-的水解程度小于电离程度,水也要电离出部分氢离子,因此c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B错误;C. pH=8.2时,c(HA-)=c(A2-),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+2c(A2-)+ c(HA-)= c(OH-)+3c(A2-),故C正确;D. pH=5.0时,溶液中的溶质为NaHA,pH由5.0调至10.5时,主要反应的离子方程式为HA-+OH-=A2-+H2O,故D正确;故选B。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】某化学兴趣小组拟用下图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁粉、稀硫酸、氢氧化钠溶液。
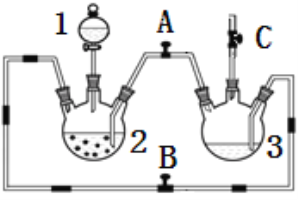
(1)稀硫酸应放在___________中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关______、打开开关_______就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由_________________.
(3)该实验使用铁粉,除反应速率可能太快外,还可能会造成的不良后果是__________________.
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O] (式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是__________。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为______________________.滴定终点的现象是_____________________.通过实验数据计算的该产品纯度为______________(用字母ac表).上表中第一次实验中记录数据明显大于后两次,其原因可能是_______。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低

