题目内容
【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
(1)真空碳热还原![]() 氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
![]()
![]()
![]()
反应![]() 的
的![]() ___________
___________![]() 用含a、b的代数式表示
用含a、b的代数式表示![]() ;
;
(2)用活性炭还原法可以处理氮氧化物![]() 某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应
某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应![]()
![]() 在
在![]() 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:
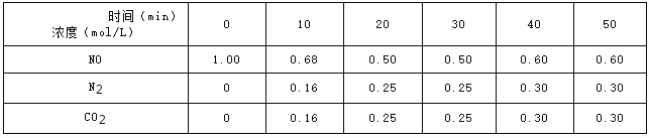
![]() 内,NO的平均反应速率
内,NO的平均反应速率![]() ________________,
________________,![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() _______________;
_______________;
![]() 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ___________
后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ___________ ![]() 填字母编号
填字母编号![]() .
.
![]() 通入一定量的NO b.加入一定量的活性炭
通入一定量的NO b.加入一定量的活性炭
![]() 加入合适的催化剂
加入合适的催化剂 ![]() 适当缩小容器的体积
适当缩小容器的体积
![]() 若30min后升高温度至
若30min后升高温度至![]() ,达到平衡时,容器中NO、
,达到平衡时,容器中NO、![]() 、
、![]() 的浓度之比为3:1:1,则Q____________
的浓度之比为3:1:1,则Q____________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 ___________
在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 ___________![]() 填选项编号
填选项编号![]() .
.
![]() 单位时间内生成
单位时间内生成![]() 的同时消耗
的同时消耗![]()
![]() 反应体系的温度不再发生改变
反应体系的温度不再发生改变
![]() 混合气体的密度不再发生改变
混合气体的密度不再发生改变
![]() 反应体系的压强不再发生改变
反应体系的压强不再发生改变
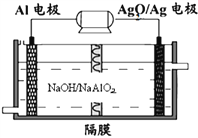
(3)铝电池性能优越,![]() 电池可用作水下动力电源,其原理如图所示:请写出该电池正极反应式_____________________________________________;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的
电池可用作水下动力电源,其原理如图所示:请写出该电池正极反应式_____________________________________________;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的![]() ___________
___________![]() 不考虑溶液体积的变化
不考虑溶液体积的变化![]() 。
。
【答案】 ![]()
![]()
![]() ad
ad ![]() bc
bc ![]() 2
2
【解析】(1)根据反应①![]() 、②
、②
![]()
![]() 再根据盖斯定律可知,①
再根据盖斯定律可知,①![]() +②即得到反应
+②即得到反应
![]() ,所以该反应的
,所以该反应的![]() (0.5a+b)
(0.5a+b)![]() 。
。
(2)![]() 分析图表数据,0~10min内,NO的平均反应速率
分析图表数据,0~10min内,NO的平均反应速率![]() (NO)=
(NO)=![]() =0.032
=0.032![]() ,化学平衡三段式列式计算平衡浓度:
,化学平衡三段式列式计算平衡浓度:
![]()
起始量(mol/L) 1 0 0
变化量(mol/L) 0.5 0.25 0.25
平衡量(mol/L) 0.5 0.25 0.25
K=![]() =0.25mol/L,因此,本题正确答案为:0.032
=0.25mol/L,因此,本题正确答案为:0.032![]() ;0.25
;0.25
②30min后,只改变某一条件,反应重新达到平衡,图表数据分析可知一氧化氮、氮气、二氧化碳浓度都增大,a.通入一定量的NO,反应正向进行,达到平衡后一氧化氮、氮气、二氧化碳浓度都增大,故a符合;b. 加入一定量的活性炭是固体,对平衡无影响,故b不符合;![]() 加入合适的催化剂,只能改变化学反应速率,不能改变平衡;浓度不变,故c不符合;
加入合适的催化剂,只能改变化学反应速率,不能改变平衡;浓度不变,故c不符合;![]() 适当缩小容器的体积,反应前后是气体体积不变的反应,平衡不动,但各物质浓度增大,故d符合;因此,本题正确答案为ad;
适当缩小容器的体积,反应前后是气体体积不变的反应,平衡不动,但各物质浓度增大,故d符合;因此,本题正确答案为ad;
③30min后,达到平衡时容器中NO、N2、CO2的浓度之比为2:1:1,升高温度至![]() ,达到平衡时,容器中NO、
,达到平衡时,容器中NO、![]() 、
、![]() 的浓度之比为3:1:1,说明升温后平衡逆向移动,逆反应为吸热反应,则正反应为放热反应,故Q<
的浓度之比为3:1:1,说明升温后平衡逆向移动,逆反应为吸热反应,则正反应为放热反应,故Q<![]() 。
。
![]() 在恒容条件下,体积不变。
在恒容条件下,体积不变。![]() 无论反应是否达到平衡,单位时间内生成
无论反应是否达到平衡,单位时间内生成![]() 的同时消耗
的同时消耗![]() ,故a错误;
,故a错误;![]() 该反应为放热反应,所以反应体系的温度随着反应的进行而改变,当平衡时,反应体系的温度不变,故b正确;c. 反应中有固体参加,反应前后固体质量不相等,所以当反应达到平衡时,混合气体的密度不再变化,故c正确;d.无论反应是否达到平衡状态,压强始终不变,故d错误;故选bc。
该反应为放热反应,所以反应体系的温度随着反应的进行而改变,当平衡时,反应体系的温度不变,故b正确;c. 反应中有固体参加,反应前后固体质量不相等,所以当反应达到平衡时,混合气体的密度不再变化,故c正确;d.无论反应是否达到平衡状态,压强始终不变,故d错误;故选bc。
(3)原电池工作时Al被氧化,应为电池的负极,Ag2O被还原,应为电池的正极,正极上氧化银得电子和水反应生成银和氢氧根离子,正极反应为:Ag2O+2e-+H2 O=2Ag+2OH-;
根据反应中得失电子数相等计算,消耗27mgAl失去电子0.003mol,则需要氢氧根离子的物质的量=0.003mol,溶液中增加氢离子的物质的量为0.003mol,则溶液中氢离子浓度=
![]() =0.01mol/L,pH=-lg0.01=2。故答案为:Ag2O+2e-+H2 O=2Ag+2OH-;2
=0.01mol/L,pH=-lg0.01=2。故答案为:Ag2O+2e-+H2 O=2Ag+2OH-;2