题目内容
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
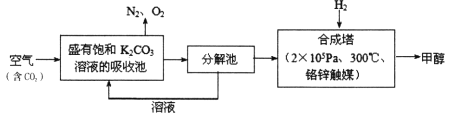
回答下列问题:
(1)进入分解池中主要物质是______;在合成塔中,若有4.4kgCO2与足量H2反应,生成气态的H2O和CH3OH,可放出5370kJ的热量,写出该反应的热化学方程式:____________。
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”:①____________;②________。
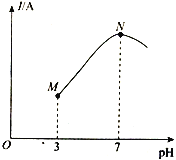
(3)一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0 mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如下图所示:
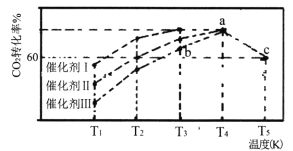
①催化剂效果最佳的是_______(填“催化剂I”.“催化剂Ⅱ”,“催化剂Ⅲ”)。b点v(正)______v(逆)(填“>”,“<”,“=”)。
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是___________。c点时该反应的平衡常数K=___________。
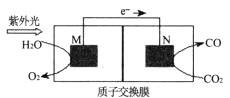
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时的总反应方程式为_________________。
(5)己知25℃时H2CO3的电离平衡常数为:Kal=4.4×10-7、Ka2=4.7×l0-ll,则反应:HCO3- +H2O![]() H2CO3+ OH-的平衡常数K=________。
H2CO3+ OH-的平衡常数K=________。
【答案】 KHCO3(或碳酸氢钾) CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol 减少大气中CO2;产生清洁能源甲醇; K2CO3可循环使用;能量可以循环利用,低碳经济等 催化剂I > 该反应为放热反应,温度开高,平衡逆向移动 2.1 2CO2
H2O(g)+CH3OH(g) △H=-53.7kJ/mol 减少大气中CO2;产生清洁能源甲醇; K2CO3可循环使用;能量可以循环利用,低碳经济等 催化剂I > 该反应为放热反应,温度开高,平衡逆向移动 2.1 2CO2![]() 2CO+O2 2.3×10-8
2CO+O2 2.3×10-8
【解析】 (1)饱和碳酸钾溶液吸收空气中的二氧化碳后生成碳酸氢钾,所以进入分解池中主要物质是KHCO3(或碳酸氢钾);在合成塔中,若有4.4kgCO2与足量H2反应,生成气态的H2O和CH3OH,可放出5370kJ的热量,由此可以求出合成1mol CH3OH(g)放出53.7kJ的热量,所以该反应的热化学方程式为CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol 。
H2O(g)+CH3OH(g) △H=-53.7kJ/mol 。
(2)该工艺中可以体现“绿色自由”构想中的“绿色”的有:①减少大气中CO2;产生清洁能源甲醇;②K2CO3可循环使用;能量可以循环利用,低碳经济等。
(3)①由图可知,相同时间内,催化剂I在较低的温度下(T3)即可使CO的转化率达到图中最高水平,说明在此温度下该反应在催化剂I的作用下化学反应速率最快,所以催化剂效果最佳的是催化剂I。b点对应的CO的转化率还没有达到该温度下的最高水平,所以反应正在向正反应方向进行,v(正)>v(逆)。
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是该反应为放热反应,温度开高,平衡逆向移动。c点时,该反应处于平衡状态,CO的转化率为60%,CO2、H2、H2O、CH3OH的变化量分别为0.6mol、1.8 mol、0.6 mol、0.6 mol,CO2、H2、H2O、CH3OH的平衡量分别为0.4mol、1.2 mol、0.6 mol、0.6 mol,则CO2、H2、H2O、CH3OH的平衡浓度分别为0.2mol/L、0.6 mol/L、0.3 mol/L、0.3 mol/L,该反应的平衡常数K= ![]() 2.1。
2.1。
(4)由图可知,该装置为原电池,负极发生2H2O-4e-=O2↑+4H+,正极发生2CO2+4e-+4H+=CO+2H2O,所以该装置工作时的总反应方程式为2CO2![]() 2CO+O2。
2CO+O2。
(5)己知25℃时H2CO3的电离平衡常数为:Kal=4.4×10-7、Ka2=4.7×l0-ll,则反应:HCO3- +H2O![]() H2CO3+ OH-的平衡常数K=
H2CO3+ OH-的平衡常数K=![]() 2.3×10-8。
2.3×10-8。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案