题目内容
下列说法中正确的是( )
| A.BF3、NF3分子的价层电子对互斥模型均为平面正三角形 |
| B.H—Cl的键能为431.8 kJ·mol—1,H—I的键能为298.7 kJ·mol—1,这可以说明HCl分子比HI分子稳定 |
| C.可燃冰是甲烷的结晶水合物,甲烷可与水形成氢键 |
| D.因为N—H键能比P—H大,所以NH3沸点比PH3高 |
B
NF3分子中的中心原子含有1对孤对电子,所以价层电子对互斥模型为正四面体,A不正确。分子的稳定性和化学键强弱有关系,B正确。由于碳的电负性较弱,不能形成氢键,C不正确。氨气中含有氢键,所以氨气的沸点高于PH3的,D不正确。答案选B。

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
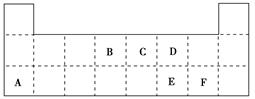
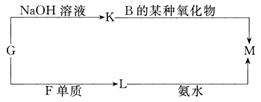
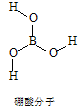
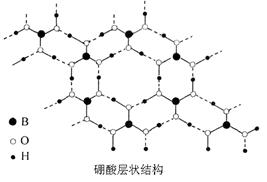
 [B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_______________________________________________。
[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_______________________________________________。