题目内容
(15分)下表是元素周期律的一部分。根据表中的10种元素,用元素符号或化学式填空。
(1)在①~⑩元素中金属性最强的金属元素是 ;第一电离能最小的元素是 ;电负性最强的元素是
(2)在①~⑩元素的最高价氧化物的水化物呈两性的是 ;⑥形成的最高价氧化物的水化物的分子式是 ;
(3)①形成的气态氢化物的结构式是 ;其中心原子采取 杂化,空间构型为
(4)①和②形成的化合物是 晶体,电子式是 ;①和④、②和④可形成 (填“离子”或“共价”)化合物,是 晶体,熔点高的是 ,理由 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ① | | ② | ③ | |
| 3 | ⑧ | | ⑨ | ④ | | ⑤ | ⑥ | ⑦ |
| 4 | | | | | | | ⑩ | |
(2)在①~⑩元素的最高价氧化物的水化物呈两性的是 ;⑥形成的最高价氧化物的水化物的分子式是 ;
(3)①形成的气态氢化物的结构式是 ;其中心原子采取 杂化,空间构型为
(4)①和②形成的化合物是 晶体,电子式是 ;①和④、②和④可形成 (填“离子”或“共价”)化合物,是 晶体,熔点高的是 ,理由 。
(1)Na Na F (2)Al(OH)3 HClO4 (3) 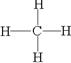 SP3 正四面体
SP3 正四面体
(4)分子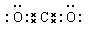 共价 原子 二氧化硅 形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量。
共价 原子 二氧化硅 形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量。
 SP3 正四面体
SP3 正四面体(4)分子
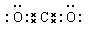 共价 原子 二氧化硅 形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量。
共价 原子 二氧化硅 形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量。考查元素周期表的结构和元素周期律的应用。根据元素在周期表的位置可判断,①~⑩分别是C、O、F、Si、S、Cl、Ar、Na、Al、Br。
(1)金属性越强,第一电离能越小,是最小的是Na。非金属性越强,电负性越大,因此是F。
(2)氢氧化铝是两性氢氧化物,Cl最高价是+7价,所以最高价氧化物的水化物的化学式为HClO4.
(3)碳的氢化物是甲烷,属于正四面体型,碳原子采取的是sp3杂化,结构式为 。
。
(4)C和O形成的CO2是分子晶体,含有极性键,电子式为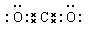 。C和Si通过极性键形成共价化合物SiC,是原子晶体,熔点高。这是由于形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量,所以熔点很高。
。C和Si通过极性键形成共价化合物SiC,是原子晶体,熔点高。这是由于形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量,所以熔点很高。
(1)金属性越强,第一电离能越小,是最小的是Na。非金属性越强,电负性越大,因此是F。
(2)氢氧化铝是两性氢氧化物,Cl最高价是+7价,所以最高价氧化物的水化物的化学式为HClO4.
(3)碳的氢化物是甲烷,属于正四面体型,碳原子采取的是sp3杂化,结构式为
 。
。(4)C和O形成的CO2是分子晶体,含有极性键,电子式为
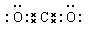 。C和Si通过极性键形成共价化合物SiC,是原子晶体,熔点高。这是由于形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量,所以熔点很高。
。C和Si通过极性键形成共价化合物SiC,是原子晶体,熔点高。这是由于形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量,所以熔点很高。
练习册系列答案
相关题目
