题目内容
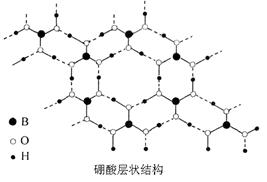
(14分)硼酸(H3BO3)是一种片层状结构的白色晶体(下图),有滑腻感,可做润滑剂。硼酸对人体受伤组织有缓和和防腐作用,故可以用于医药和食品防腐等方面。回答下列问题:
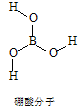
(1)B原子结构示意图为_______________________。
(2)硼酸为一元弱酸,在水中电离方程式为H3BO3+H2O [B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_______________________________________________。
[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_______________________________________________。
(3)下列有关硼酸晶体的说法正确的是_______________。
A、H3BO3分子的稳定性与氢键有关
B、平均1 mol H3BO3的晶体中有3 mol氢键
C、硼酸晶体中层与层之间作用力是范德华力
D、B为sp2杂化,同一层内主要作用力是共价键和氢键
(4)根据对角线规则,与B性质相似的元素是________。
(5)含氧酸的通式为(HO)mROn,根据非羟基氧原子数判断,与H3BO3酸性最接近的是______。
A HClO B.H4SiO4 C.H3PO4 D.HNO2
(6)一种硼酸盐的阴离子为B3O6n-,n=______;B3O6n-结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O6n-的结构图(注明所带电荷数):
____________________________________________________________。


(1)B原子结构示意图为_______________________。
(2)硼酸为一元弱酸,在水中电离方程式为H3BO3+H2O
 [B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_______________________________________________。
[B(OH)4]-+H+,写出硼酸与NaOH溶液反应的离子方程式_______________________________________________。(3)下列有关硼酸晶体的说法正确的是_______________。
A、H3BO3分子的稳定性与氢键有关
B、平均1 mol H3BO3的晶体中有3 mol氢键
C、硼酸晶体中层与层之间作用力是范德华力
D、B为sp2杂化,同一层内主要作用力是共价键和氢键
(4)根据对角线规则,与B性质相似的元素是________。
(5)含氧酸的通式为(HO)mROn,根据非羟基氧原子数判断,与H3BO3酸性最接近的是______。
A HClO B.H4SiO4 C.H3PO4 D.HNO2
(6)一种硼酸盐的阴离子为B3O6n-,n=______;B3O6n-结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,画出B3O6n-的结构图(注明所带电荷数):
____________________________________________________________。
(1)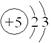 (2分) (2)H3BO3+OH-=[B(OH)4]-(3分)
(2分) (2)H3BO3+OH-=[B(OH)4]-(3分)
(3) BCD (3分) (4) Si(1分) (5) AB(2分)
(6) 3(1分)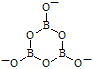 或
或 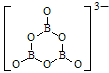 (2分)
(2分)
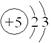 (2分) (2)H3BO3+OH-=[B(OH)4]-(3分)
(2分) (2)H3BO3+OH-=[B(OH)4]-(3分)(3) BCD (3分) (4) Si(1分) (5) AB(2分)
(6) 3(1分)
 或
或  (2分)
(2分)(1)B是第二周期第ⅢA,所以原子结构示意图为 。
。
(2)根据硼酸的电离方程式可知,反应的离子方程式为H3BO3+OH-=[B(OH)4]-。
(3)分子的稳定性和化学键有关系。氢键一般影响的是物理性质,A不正确。硼酸中3个氧原子均形成1个氢键,所以平均1 mol H3BO3的晶体中有3 mol氢键,B正确。层和层靠分子间作用力连接,所以C正确。硼原子的最外层电子全部参与成键,没有孤对电子,所以是sp2杂化,D也正确。答案选BCD。
(4)和硼处于对角线位置的是硅。
(5)含氧酸中非羟基氧原子数越多,酸性越强。在硼酸中非羟基氧原子数为0,所以和硼酸酸性接近的是选项AB。CD中非羟基氧原子数均是1。答案选AB。
(6)硼是第ⅢA,最高价是+3价,氧是-2价,所以n=2×6-3×3=3。B3O6n-结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,所以其结构图为 或
或  。
。
 。
。(2)根据硼酸的电离方程式可知,反应的离子方程式为H3BO3+OH-=[B(OH)4]-。
(3)分子的稳定性和化学键有关系。氢键一般影响的是物理性质,A不正确。硼酸中3个氧原子均形成1个氢键,所以平均1 mol H3BO3的晶体中有3 mol氢键,B正确。层和层靠分子间作用力连接,所以C正确。硼原子的最外层电子全部参与成键,没有孤对电子,所以是sp2杂化,D也正确。答案选BCD。
(4)和硼处于对角线位置的是硅。
(5)含氧酸中非羟基氧原子数越多,酸性越强。在硼酸中非羟基氧原子数为0,所以和硼酸酸性接近的是选项AB。CD中非羟基氧原子数均是1。答案选AB。
(6)硼是第ⅢA,最高价是+3价,氧是-2价,所以n=2×6-3×3=3。B3O6n-结构中只有一个六元环,B的空间化学环境相同,O有两种空间化学环境,所以其结构图为
 或
或  。
。
练习册系列答案
相关题目
 I对治疗肿瘤有一定疗效。该原子的中子数是
I对治疗肿瘤有一定疗效。该原子的中子数是