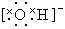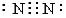题目内容
(12分)A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)推断B元素在元素周期表中的位置 ,写出C的单质的电子式 。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为 。
(3)E、F、G三种元素所形成的简单离子,其离子半径由大到小的顺序是 。(用离子符号表示)
(4)用电子式表示化合物E2F的形成过程 。
(5)下图为某新型发电装置示意图,其负极电极反应为 。
请用化学用语回答:
(1)推断B元素在元素周期表中的位置 ,写出C的单质的电子式 。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为 。
(3)E、F、G三种元素所形成的简单离子,其离子半径由大到小的顺序是 。(用离子符号表示)
(4)用电子式表示化合物E2F的形成过程 。
(5)下图为某新型发电装置示意图,其负极电极反应为 。

(1)第二周期 ⅣA族(2分)  (2分)
(2分)
(2) H2O2+SO2=H2SO4(2分) (3) S2->Cl->Na+(2分)
(4)略(2分)
(5) H2-2e-+2OH-=2H2O(2分)
 (2分)
(2分)(2) H2O2+SO2=H2SO4(2分) (3) S2->Cl->Na+(2分)
(4)略(2分)
(5) H2-2e-+2OH-=2H2O(2分)
“A元素原子核内无中子”,则A为11H;B元素的核外电子排布为2 4,则B为碳元素;“D是地壳中含量最多的元素”,则D为氧元素、C为氮元素;“E是短周期中金属性最强的元素”,则E为钠元素;“F与G位置相邻,G是同周期元素中原子半径最小的元素”,则G为氯元素、F为硫元素;
(1)电子层数=周期序数,最外层电子数=主族序数;
(2)H2O2(表现氧化性)与SO2(表现还原性)发生氧化还原反应;
(3)具有相同核外电子排布的离子,原子序数越大,离子半径越小,故S2->Cl-;
再S2-、Cl-核外有三层电子,Na+核外有两层电子,故S2->Cl->Na+;
(4)每个钠原子失去最外层的1个电子;硫原子得两个电子,使最外层达8电子稳定结构;
Na2S的电子式为:
(5)构成碱性条件下的氢氧原电池,故(-):H2-2e-+2OH-=2H2O;
(1)电子层数=周期序数,最外层电子数=主族序数;
(2)H2O2(表现氧化性)与SO2(表现还原性)发生氧化还原反应;
(3)具有相同核外电子排布的离子,原子序数越大,离子半径越小,故S2->Cl-;
再S2-、Cl-核外有三层电子,Na+核外有两层电子,故S2->Cl->Na+;
(4)每个钠原子失去最外层的1个电子;硫原子得两个电子,使最外层达8电子稳定结构;
Na2S的电子式为:

(5)构成碱性条件下的氢氧原电池,故(-):H2-2e-+2OH-=2H2O;

练习册系列答案
相关题目

 I对治疗肿瘤有一定疗效。该原子的中子数是
I对治疗肿瘤有一定疗效。该原子的中子数是