题目内容
5.某种锂电池用金属和石墨作电极材料,电解质量溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(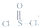 )中而形成的,电池总反应方程式为:4Li+2SOCl2=4LiCl+SO2+S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:4Li+2SOCl2=4LiCl+SO2+S,下列叙述中正确的是( )| A. | 电解质溶液中混入水,对电池反应无影响 | |
| B. | 金属锂被还原,作电池的负极 | |
| C. | 电池工作过程中,Cl-向石墨电极移动 | |
| D. | 电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1 |
分析 根据电池反应式知,放电时,Li元素化合价由0价变为+1价、S元素化合价由+4价变为0价,所以Li作负极、石墨作正极,负极反应式为Li-e-=Li+,
A.Li性质较活泼,易和水发生氧化还原反应;
B.Li失电子作还原剂,被氧化;
C.放电时,电解质中阳离子向正极移动、阴离子向负极移动;
D.根据方程式知,放电时,4molLi失去4mol电子,析出1molS.
解答 解:根据电池反应式知,放电时,Li元素化合价由0价变为+1价、S元素化合价由+4价变为0价,所以Li作负极、石墨作正极,负极反应式为Li-e-=Li+,
A.Li性质较活泼,易和水发生氧化还原反应,导致SOCl2无法参加反应,所以电解质为非水溶液,故A错误;
B.Li元素化合价由0价变为+1价,失电子作还原剂,被氧化,为原电池负极,故B错误;
C.放电时,电解质中阳离子向正极移动、阴离子向负极移动,Li是负极、石墨是正极,所以氯离子向负极Li电极移动,故C错误;
D.根据方程式知,放电时,4molLi失去4mol电子,析出1molS,则金属锂提供的电子与正极区析出硫的物质的量之比为4:1,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高考高频点,会根据元素化合价变化确定正负极及发生的反应,难点是电极反应式的书写,知道原电池电解质溶液中阴阳离子移动方向及原因,题目难度不大.

练习册系列答案
相关题目
15.X、Y、Z、W是原子序数依次增大的四种短周期元素.其中只有一种是金属元素,X、W同主族且能形成一种离子化合物WX;Y的气态氢化物、最高价氧化物的水化物可反应生成一种盐;Z原子的最外层电子数与其电子总数之比为3:4.下列说法中正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | 氢化物稳定性:Y>Z | |
| C. | WY3中只有离子键没有共价键 | |
| D. | X与Z可形成l0电子分子和18电子分子 |
16.用下列实验装置进行相应的实验,不能达到实验目的是( )
| A | B | C | D | |
| 装置 | 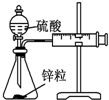 | 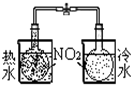 | 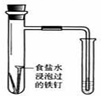 | 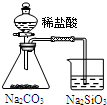 |
| 实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
13.化学与科学、技术、社会、环境密切相关,下列有关说法正确的是( )
| A. | 节日燃放焰火,其颜色是某些金属元素焰色反应所致 | |
| B. | 糖类、蛋白质、油脂等营养物质都属于天然高分子化合物 | |
| C. | “温室效应”、“酸雨”、“光合作用”等现象都与CO2有关 | |
| D. | 浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 |
20.我省近年来以铁矿石为原料的产业发展迅猛,下列有关说法正确的是( )
| A. | 以焦炭和铁矿石为原料炼铁的原理是用焦炭直接还原化合态的铁 | |
| B. | 据报道,庐江磁性材料产生“磁”力无穷,磁性氧化铁的化学式是Fe2O3 | |
| C. | 为证明某铁矿石中存在铁离子,可将铁矿石溶于硝酸后,再加KSCN溶液 | |
| D. | 利用铁矿石制得的能除去污水中的,可知相同条件下,Ksp(FeS)>Ksp(HgS) |
10.某小组用下图装置进行实验,下列说法正确的是( )
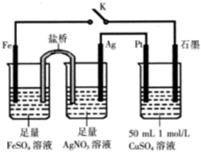

| A. | 盐桥中的电解质可以用KCl | |
| B. | 闭合K,外电路电流方向为Fe电极→石墨电极 | |
| C. | 闭合K,石墨电极上只生成铜 | |
| D. | 导线中流过0.15 mol e-时,加入5.55gCu2(OH)2CO3,CuSO4溶液可恢复原组成 |
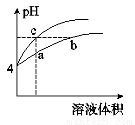
1.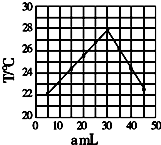 将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )
将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )
 将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )
将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )| A. | 做该实验时,环境温度为22摄氏度 | |
| B. | 该实验表明化学能可能转化为热能 | |
| C. | NaOH溶液的浓度约为0.1mol/L | |
| D. | 该实验表明有水生成的反应都是放热反应 |
 NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。