题目内容
有关物质结构的下列说法中正确的是
| A.碘升华时破坏了共价键 |
| B.含极性键的共价化合物一定是电解质 |
| C.氯化钠固体中的离子键在溶于水时被破坏 |
| D.HF的分子间作用力大于HCl,故HF比HCl更稳定 |
C
解析试题分析:A. 碘是由分子组成的物质,升华时破坏的是分子间作用力,与分子内的共价键无关。错误。B. 含极性键的共价化合物可能是电解质,也可能是非电解质。如H2O是电解质。CCl4是非电解质,二者都含有共价键。错误。C. 氯化钠是由离子键构成离子晶体,当固体在溶于水时离子键被破坏。正确。D. HF的分子内共价键大于HCl,故HF比HCl更稳定。错误。
考点:考查有关物质结构的的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质既含离子键又含共价键的是
| A.CO2 | B.NaOH | C.CaCl2 | D.C6H6 |
下列说法不正确的是
①非金属元素构成的单质中一定存在共价键;②非金属之间形成的化合物一定是共价化合物;③非金属的气态氢化物中一定存在极性共价键;④离子化合物中一定含有离子键;⑤金属元素和非金属元素形成的化合物一定是离子化合物;⑥在一种化合物中只能存在一种类型的化学键;⑦含共价键的化合物不一定是共价化合物;⑧含离子键的化合物一定是离子化合物;⑨氯化钠和HCl溶于水都发生电离,克服粒子间作用力的类型相同
| A.③④⑦⑧ | B.①③④⑦⑧ | C.①②⑤⑥⑨ | D.①④⑦⑨ |
下列中心原子采取sp2杂化且为非极性分子的是:
| A.CS2 | B.H2S | C.SO2 | D.SO3 |
用价层电子对互斥理论预测H2S和CH2O分子的立体结构,两个结论都正确的是
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
氢化铵(NH4H)与氯化铵的结构相似,又知它与水反应有气体生成。下列关于氢化铵叙述不正确的是( )。
| A.是离子化合物,含有离子键和共价键 |
B.电子式是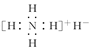 |
| C.与水反应时,是还原剂 |
| D.固体投入少量的水中,有两种气体产生 |
在以下的分子或离子中,空间结构的几何形状不是三角锥形的是( )
| A.NF3 | B.CH3— | C.BF3 | D.H3O+ |
下列说法中正确的是( )
| A.非金属元素原子组成的化合物不可能是离子化合物 |
| B.ⅠA族元素的金属性不一定比ⅡA族元素的金属性强 |
| C.同一主族元素组成的化合物一定是共价化合物 |
| D.通过化学变化可以实现18O与16O间的相互转化 |