题目内容
下列中心原子采取sp2杂化且为非极性分子的是:
| A.CS2 | B.H2S | C.SO2 | D.SO3 |
D
解析试题分析:原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子是非极性分子。分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,据此可以判断。A、根据价层电子对互斥理论可知,CS2分子中碳原子含有的孤对电子对数=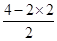 =0,因此二硫化碳是直线型结构,属于非极性分子,碳原子是sp杂化,A不正确;B、H2S分子中S原子含有的孤对电子对数=
=0,因此二硫化碳是直线型结构,属于非极性分子,碳原子是sp杂化,A不正确;B、H2S分子中S原子含有的孤对电子对数=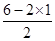 =2,因此H2S是V型结构,属于极性分子,S原子是sp3杂化,B不正确;C、SO2分子中S原子含有的孤对电子对数=
=2,因此H2S是V型结构,属于极性分子,S原子是sp3杂化,B不正确;C、SO2分子中S原子含有的孤对电子对数=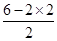 =1,因此SO2是V型结构,属于极性分子,S原子是sp2杂化,C不正确;D、三氧化硫分子中S原子含有的孤对电子对数=
=1,因此SO2是V型结构,属于极性分子,S原子是sp2杂化,C不正确;D、三氧化硫分子中S原子含有的孤对电子对数=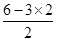 =0,因此SO3是平面三角形结构,属于非极性分子,S原子是sp2杂化,D正确,答案选D。
=0,因此SO3是平面三角形结构,属于非极性分子,S原子是sp2杂化,D正确,答案选D。
考点:考查分子极性、杂化轨道类型的判断

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案有关物质结构的下列说法中正确的是
| A.碘升华时破坏了共价键 |
| B.含极性键的共价化合物一定是电解质 |
| C.氯化钠固体中的离子键在溶于水时被破坏 |
| D.HF的分子间作用力大于HCl,故HF比HCl更稳定 |
科学家在《Science》上发表论文,宣布发现了铝的超原子结构Al13和Al14,当这类超原子具有40个价电子(对于主族元素的原子,外围电子又称为价电子)时最稳定,在质谱仪上可检测到稳定到Al13-和Al142+。下列说法错误的是
| A.Al13和Al14互为同位素 |
| B.Al13超原子中Al原子间是通过共价键结合的 |
| C.Al13和Al的化学性质相似,都具有较强的还原性 |
| D.Al14和稀盐酸反应的化学方程式可表示为Al14+2HCl→Al14Cl2+H2↑ |
把铜粉放入装有浓氨水的试管中,塞紧试管塞,振荡后发现试管塞越来越紧,且溶液逐渐变为浅黄色(近乎无色)溶液,打开试管塞后,溶液迅速变为蓝色溶液。则下列说法正确的是( )
| A.试管塞越来越紧,是因为反应消耗了大量NH3 |
| B.溶液逐渐变为浅黄色,是因为反应生成了少量的NO2 |
C.溶液迅速变为蓝色溶液,是因为反应生成了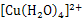 |
| D.上述反应原理可用于测定O2的含量 |
以下说法正确的是
| A.共价化合物内部可能有极性键和非极性键 |
| B.原子或离子间相互的吸引力叫化学键 |
| C.非金属元素间只能形成共价键 |
| D.金属元素与非金属元素的原子间只形成离子键 |
随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。 下列有关说法中,正确的是
| A.N5+ 离子中含有36个电子 |
| B.H2与H3属于同素异形体 |
| C.C60720 |
| D.O2与O4属于同位素 |
北京大学和中国科学院的化学工作者最近研制出碱金属与C60形成的球碳盐K3C60, 实验测知该物质属于离子晶体,且有良好的超导性,下列K3C60的组成和结构分析正确的是( )
| A.该物质分子式为K3C60 |
| B.K3C60的摩尔质量是837 |
| C.1molK3C60中含有的离子键的数目为63×6.02×1023个 |
| D.K3C60中既有离子键 ,又有共价键 ,在熔融状态下能导电 |
下列说法正确的是
| A.Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性 |
| B.将Ba(OH)2溶液滴到明矾溶液中,当SO42-刚沉淀完时,铝以Al(OH)3的形式存在 |
| C.氢氧燃料电池以铂作电极,KOH溶液作电解质溶液,电池工作时溶液中的阴离子移向正极 |
| D.能通过化合反应制得FeCl2和Fe(OH)3 |
下列关于σ键和π键的理解不正确的是( )
| A.σ键能单独形成,而π键一定不能单独形成 |
| B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转 |
| C.双键中一定有一个σ键、一个π键,三键中一定有一个σ键、两个π键 |
| D.气体单质中一定存在σ键,可能存在π键 |