题目内容
下列依据热化学方程式得出的结论正确的是( )
| A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ· mol—1则氢气的燃烧热为△H=-241.8 kJ· mol—1 |
| B.已知C(石墨,s)=C(金刚石,s);△H=+1.9kJ·mol-1,可知石墨比金刚石更稳定 |
| C.已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4 kJ· mol—1可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.4 kJ |
| D.已知2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2,则△H1>△H2 |
B
试题分析:A、氢气的燃烧热指的是1摩尔氢气完全燃烧生成液态水,错误;B、石墨转化为金刚石是吸热反应,说明石墨的能量低,因此石墨稳定,正确;C、醋酸和氢氧化钠发生中和反应,醋酸电离过程要吸热,因此放出热量小于57.4 kJ,错误;D、碳不完全燃烧生成CO放出热量少,因此△H2大,错误。

练习册系列答案
相关题目
 CO(g) ΔH="-110.5" kJ·mol-1
CO(g) ΔH="-110.5" kJ·mol-1 、
、 , NO2中氮氧键的键能为466 kJ·mol-1,N2O4中N-N键键能为167 kJ·mol-1,氮氧键的键能为438.5 kJ·mol-1,写出N2O4转化为NO2的热化学方程式 ;
, NO2中氮氧键的键能为466 kJ·mol-1,N2O4中N-N键键能为167 kJ·mol-1,氮氧键的键能为438.5 kJ·mol-1,写出N2O4转化为NO2的热化学方程式 ;  NiO(OH)+MH
NiO(OH)+MH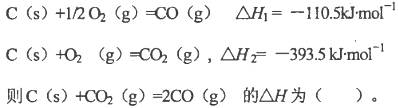

 O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②
O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②