题目内容
(6分)
(1)在25℃、101kPa下,1g CH4(g)完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
(2)Zn(s) + O2(g) = 2ZnO(s) ΔH1= ?702 kJ/mol
2Hg(l) + O2(g) = 2HgO(s) ΔH2= ?182 kJ/mol
由此可知ZnO(s) + Hg(l) = Zn(s) + HgO(s) △H3= 。
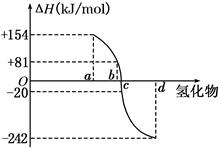
(3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。右图是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
(1)在25℃、101kPa下,1g CH4(g)完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
(2)Zn(s) + O2(g) = 2ZnO(s) ΔH1= ?702 kJ/mol
2Hg(l) + O2(g) = 2HgO(s) ΔH2= ?182 kJ/mol
由此可知ZnO(s) + Hg(l) = Zn(s) + HgO(s) △H3= 。
(3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。右图是1mol NO2(g)和1mol CO(g)反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。

(6分,每空2分)
(1)CH4(g)+ 2O2(g)= CO2(g)+ 2H2O(l) ΔH=-880kJ/mol
(2)ΔH3=+260kJ/mol
(3)NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234kJ/mol
(1)CH4(g)+ 2O2(g)= CO2(g)+ 2H2O(l) ΔH=-880kJ/mol
(2)ΔH3=+260kJ/mol
(3)NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234kJ/mol
(1)设1mol甲烷燃烧所放出热为X
CH4(g)+ 2O2(g)= CO2(g)+ 2H2O(l) ΔH
16g X
1g 55 kJ
X=16x55=880KJ
即CH4(g)+ 2O2(g)= CO2(g)+ 2H2O(l) ΔH=-880kJ/mol
(2)由所求方程式可知需找到ZnO(s) 和Hg(l) 观察可得在第一个方程生成物,第二个方程反应物中,故用第二个方程减去第一个方程得2ZnO(s) + 2Hg(l) =2Zn(s) + 2HgO(s) △H3=+520kJ/mol。方程同时除以2可得ZnO(s) + Hg(l) = Zn(s) + HgO(s) ΔH3=+260kJ/mol
(3)E1表示断键所吸收的能量,E2表示成键所放出的能量,由图可知E2大于E1,即为放热反应,则焓变ΔH= E1-E2=-234kJ/mol 即方程式为NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234kJ/mol
CH4(g)+ 2O2(g)= CO2(g)+ 2H2O(l) ΔH
16g X
1g 55 kJ
X=16x55=880KJ
即CH4(g)+ 2O2(g)= CO2(g)+ 2H2O(l) ΔH=-880kJ/mol
(2)由所求方程式可知需找到ZnO(s) 和Hg(l) 观察可得在第一个方程生成物,第二个方程反应物中,故用第二个方程减去第一个方程得2ZnO(s) + 2Hg(l) =2Zn(s) + 2HgO(s) △H3=+520kJ/mol。方程同时除以2可得ZnO(s) + Hg(l) = Zn(s) + HgO(s) ΔH3=+260kJ/mol
(3)E1表示断键所吸收的能量,E2表示成键所放出的能量,由图可知E2大于E1,即为放热反应,则焓变ΔH= E1-E2=-234kJ/mol 即方程式为NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234kJ/mol

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
 成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)
成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中) CH3OH(g) ΔH1
CH3OH(g) ΔH1 (g) ΔH =-1275.6 kJ·mol-1
(g) ΔH =-1275.6 kJ·mol-1
 。
。
 移向 (填“a”或“b”)电极,
移向 (填“a”或“b”)电极, (3)乙池中发生反应的离子方程式为 ;
(3)乙池中发生反应的离子方程式为 ;
 (标准状况下)。如何检验A处的产物 。
(标准状况下)。如何检验A处的产物 。 熔点、沸点数据如下:
熔点、沸点数据如下:
 62
62 750
750 。
。 试剂中最适宜的试剂是
试剂中最适宜的试剂是