题目内容
已知两个热化学方程式: C(s)+O2(g)==CO2(g) △H = -393.5kJ/mol
2H2(g)+O2(g)==2H2O(g) △H = -483.6kJ/mol
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是
2H2(g)+O2(g)==2H2O(g) △H = -483.6kJ/mol
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是
| A.1:1 | B.1:2 | C.2:3 | D.3:2 |
A
正确答案:A
炭粉与H2的物质的量分别为x和y
X+y=0.2mol,393.5x+241.8y=63.53kJ
解得x=y=0.1mol,故A正确。

练习册系列答案
相关题目
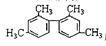 的烃,下列说法正确的是
的烃,下列说法正确的是  AH不同
AH不同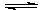 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol ,下列说法正确的是
,下列说法正确的是 2NH3(g)△H=-38.6KJ·mol-1
2NH3(g)△H=-38.6KJ·mol-1