题目内容
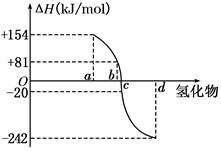
(8分)(I)已知:在298 K、1.01KPa下,由稳定的单质发生反应生成1 mol气态化合物的反应热叫该化合物的生成热(ΔH).如图所示为氧族元素氢化物a、b、c、d的生成热数据示意图.试回答下列问题:
请你归纳出
(I)非金属元素氢化物的稳定性与其反应热ΔH的关系____________;
写出硒化氢在298 K、1.01KPa下,发生分解反应的反应热△H =______ KJ/mol。
(II)已知:拆开1mol Si—Si键,1mol O=O键,1mol Si—O键分别需要的能量是AkJ、BkJ、CkJ,则硅与氧气反应生成1molSiO2的反应热△H ="=" KJ/mol。
(III)一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。写出该燃料电池的电极反应:
负极: 正极:

请你归纳出
(I)非金属元素氢化物的稳定性与其反应热ΔH的关系____________;
写出硒化氢在298 K、1.01KPa下,发生分解反应的反应热△H =______ KJ/mol。
(II)已知:拆开1mol Si—Si键,1mol O=O键,1mol Si—O键分别需要的能量是AkJ、BkJ、CkJ,则硅与氧气反应生成1molSiO2的反应热△H ="=" KJ/mol。
(III)一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。写出该燃料电池的电极反应:
负极: 正极:
( 8分)(1)非金属元素氢化物越稳定,△H越小;△H=" –" 81KJ/mol(1分)
(2)△H=(2A+B–4C)kJ/mol(1分)
(3)C4H10+13 O2- -26e-=4CO2+5H2O (2分)O2+4e-=2O2- (2分)
(2)△H=(2A+B–4C)kJ/mol(1分)
(3)C4H10+13 O2- -26e-=4CO2+5H2O (2分)O2+4e-=2O2- (2分)
(1)非金属元素越活泼,生成的氢化物越稳定,放出的热量越多,生成热△H越小;故氢化物a、b、c、d的分别为H2Te、H2Se、H2S、H2O,H2Se的生成热为+81KJ/mol,反之,硒化氢在298 K、1.01KPa下,发生分解反应的反应热△H=– 81KJ/mol
(II)硅的燃烧反应为:Si+O2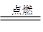 SiO2,其中硅晶体、SiO2晶体均为原子晶体,1mol硅晶体中含有2molSi—Si键,1mol中含有4molSi—O键,故吸收热量为:2A+B,而放出的热量为4C,故生成1molSiO2的反应热△H=反应的键能总和—生成物的键能总和=(2A+B–4C)kJ/mol
SiO2,其中硅晶体、SiO2晶体均为原子晶体,1mol硅晶体中含有2molSi—Si键,1mol中含有4molSi—O键,故吸收热量为:2A+B,而放出的热量为4C,故生成1molSiO2的反应热△H=反应的键能总和—生成物的键能总和=(2A+B–4C)kJ/mol
(III)燃料电池的总反应为:2C4H10+13O2=8CO2+10H2O
氧气在正极得电子:O2+4e-=2O2-
丁烷在负极失电子并得到O2-:C4H10+13 O2--26e-=4CO2+5H2O(总反应减去正极反应即可)
(II)硅的燃烧反应为:Si+O2
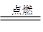 SiO2,其中硅晶体、SiO2晶体均为原子晶体,1mol硅晶体中含有2molSi—Si键,1mol中含有4molSi—O键,故吸收热量为:2A+B,而放出的热量为4C,故生成1molSiO2的反应热△H=反应的键能总和—生成物的键能总和=(2A+B–4C)kJ/mol
SiO2,其中硅晶体、SiO2晶体均为原子晶体,1mol硅晶体中含有2molSi—Si键,1mol中含有4molSi—O键,故吸收热量为:2A+B,而放出的热量为4C,故生成1molSiO2的反应热△H=反应的键能总和—生成物的键能总和=(2A+B–4C)kJ/mol(III)燃料电池的总反应为:2C4H10+13O2=8CO2+10H2O
氧气在正极得电子:O2+4e-=2O2-
丁烷在负极失电子并得到O2-:C4H10+13 O2--26e-=4CO2+5H2O(总反应减去正极反应即可)

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
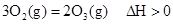 ,下列说法正确的是
,下列说法正确的是
 2H2O(l)△H= -142.9kJ·mol—1
2H2O(l)△H= -142.9kJ·mol—1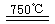 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg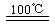 HgBr2+H2
HgBr2+H2 ______________ ④2HgO
______________ ④2HgO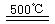 2Hg+O2↑
2Hg+O2↑
 CO2(g)+ H2(g); △H<0。
CO2(g)+ H2(g); △H<0。