题目内容
8.利用电负性数值可以预测( )| A. | 分子的极性 | B. | 分子的对称性 | C. | 分子的空间构型 | D. | 化学键的极性 |
分析 元素的原子在化合物中把电子吸引向自己的本领叫做元素的电负性电负性,元素的电负性越大,其吸引电子的能力越大,元素电负性数值越大,原子在形成化学键时对成键电子的吸引力越强.
解答 解:元素的电负性越大,其吸引电子的能力越大,元素电负性数值越大,原子在形成化学键时对成键电子的吸引力越强,则形成的化学键极性就越大,所以电负性数值可以预测化学键的极性,故选D.
点评 本题考查了电负性数值的应用,明确电负性的概念及元素周期律是解本题关键,根据元素电负性与化学键的关系分析解答,难度不大.

练习册系列答案
相关题目
18.1molAl分别与足量下列物质反应,所得金属的物质的量最少的是( )
| A. | WO3 | B. | Fe3O4 | C. | MnO2 | D. | Fe2O3 |
19.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )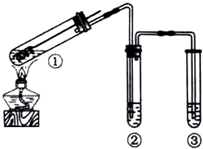

| A. | 为确认CuSO4生成,向①中加水,观察颜色 | |
| B. | 上下移动①中铜丝可控制SO2的量 | |
| C. | ②中选用品红溶液验证SO2的生成 | |
| D. | ③中选用NaOH溶液吸收多余的SO2 |
16.下列各种有机物能发生加成、加聚、酯化、水解、中和反应的是( )
| A. | 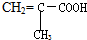 | B. | 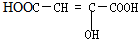 | C. | HCOOCH=CHCOOH | D. | CH2=C-COOCH3 |
3.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3.关于该物质的说法正确的是( )
| A. | 该物质属于两性氢氧化物 | |
| B. | 该药剂不适合于胃溃疡患者服用 | |
| C. | 1mol NaAl(OH)2CO3最多可消耗3molH+ | |
| D. | 该物质是Al(OH)3和Na2CO3的混合物 |
13.下列四种元素中,其单质的氧化性最强的是( )
| A. | 基态原子含有未成对电子最多的第二周期元素 | |
| B. | 某激发态为1s22s12p3的原子 | |
| C. | 基态原子最外层电子排布为2s22p6的元素 | |
| D. | 基态原子最外层电子排布为3s23p5的元素 |
 A2(g)+B2(g)达到平衡状态的标志是( )
A2(g)+B2(g)达到平衡状态的标志是( ) nmolA2的同时消耗n molAB
nmolA2的同时消耗n molAB