题目内容
18.1molAl分别与足量下列物质反应,所得金属的物质的量最少的是( )| A. | WO3 | B. | Fe3O4 | C. | MnO2 | D. | Fe2O3 |
分析 1molAl转移3mol的电子,所得金属的物质的量最少,金属氧化物中金属的化合价最高,由此分析解答.
解答 解:WO3金属的化合价是+6,Fe3O4金属的化合价是+$\frac{8}{3}$,MnO2金属的化合价是+4,Fe2O3金属的化合价是+3,所以得到W的物质的量最少,故选A.
点评 本题根据电子得失守恒,从化合价的角度分析解答,在转移电子相同的情况下,要得到金属的物质的量最少,金属在化合物中的价态最高,这是解题的关键.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | CH2CH2CH3的三个碳原子在一条直线 | |
| B. | CH2=CHCH3三个碳原子共平面 | |
| C. | 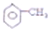 所有原子共平面 所有原子共平面 | |
| D. | CH4所有原子共平面 |
6.X、Y都是短周期元素,原子半径Y>X,它们可能形成的化合物为XY2,由此得出的正确判断是( )
| A. | X、Y可能在同一周期 | B. | X在Y的前一周期 | ||
| C. | X一定是金属元素 | D. | X一定是第三周期ⅡA或ⅣA族元素 |
13.如图所示,在用锌片、铜片和稀硫酸组成的原电池装置中,下列说法正确的是( )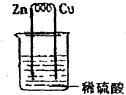

| A. | 铜片上的反应为:Cu-2e-=Cu2+ | B. | 锌片上的反应为:2H++2e-=H2↑ | ||
| C. | 锌片是负极,铜片是正极 | D. | 反应一段时间后,溶液的pH变小 |
3.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,总反应式为:2C2H6+7O2+8KOH═4K2CO3+10H2O,下列推断正确的是( )
| A. | 负极反应为7O2+14 H2O+28e-→28OH- | |
| B. | 每消耗1molC2H6,则电路上转移的电子为14mol | |
| C. | 放电一段时间后,负极周围的pH升高 | |
| D. | 放电过程中KOH的物质的量浓度减小 |
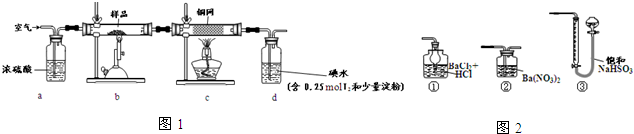
7.从海水中提取的溴占世界产溴量的$\frac{1}{3}$.已知溴水量橙色,将SO2气体通入溴水时,可以观察到溴水褪色.则下列有关叙述中正确的是( )
| A. | SO2使溴水褪色,显示了SO2的漂白性 | |
| B. | SO2使溴水褪色,显示了SO2的还原性 | |
| C. | 从溴水中提取单质溴,可以用乙醇进行萃取 | |
| D. | SO2使溴水褪色和使品红褪色原理相同 |
8.利用电负性数值可以预测( )
| A. | 分子的极性 | B. | 分子的对称性 | C. | 分子的空间构型 | D. | 化学键的极性 |