题目内容
19.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )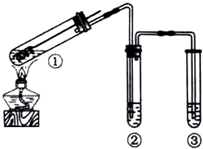
| A. | 为确认CuSO4生成,向①中加水,观察颜色 | |
| B. | 上下移动①中铜丝可控制SO2的量 | |
| C. | ②中选用品红溶液验证SO2的生成 | |
| D. | ③中选用NaOH溶液吸收多余的SO2 |
分析 A.Cu和浓硫酸在加热条件下反应生成硫酸铜,硫酸铜溶液呈蓝色;
B.在加热条件下,Cu丝和浓硫酸接触才能发生反应;
C.二氧化硫能使品红溶液褪色;
D.二氧化硫属于酸性氧化物,能和碱反应生成盐和水.
解答 解:A.Cu和浓硫酸在加热条件下反应生成硫酸铜,硫酸铜溶液呈蓝色,所以不需要向①中加水检验硫酸铜,故A错误;
B.在加热条件下,Cu丝和浓硫酸接触才能发生反应,所以上下移动①中铜丝可控制SO2的量,故B正确;
C.二氧化硫能和有色物质反应生成无色物质而具有漂白性,二氧化硫能使品红溶液褪色,则可以用品红溶液检验二氧化硫,故C正确;
D.二氧化硫有毒,不能直接排空,但二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以可以用NaOH溶液处理尾气,故D正确;
故选A.
点评 本题以浓硫酸和铜的反应为载体考查浓硫酸性质,侧重考查元素化合物知识及基本操作,知道二氧化硫具有漂白性、还原性、氧化性且属于酸性氧化物,注意从性质及环保方面分析解答,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
7.从海水中提取的溴占世界产溴量的$\frac{1}{3}$.已知溴水量橙色,将SO2气体通入溴水时,可以观察到溴水褪色.则下列有关叙述中正确的是( )
| A. | SO2使溴水褪色,显示了SO2的漂白性 | |
| B. | SO2使溴水褪色,显示了SO2的还原性 | |
| C. | 从溴水中提取单质溴,可以用乙醇进行萃取 | |
| D. | SO2使溴水褪色和使品红褪色原理相同 |
14.下列各组离子,在水溶液中不能大量共存的是( )
| A. | H+、K+、Cl-、NO3- | B. | K+、A13+、Cl-、AlO2- | ||
| C. | Na+、K+、CO32-、NO3- | D. | A13+、Cu2+、SO42-、I- |
4.下列物质既能够与强酸又能够与强碱反应,且反应后都能产生气体的是( )
| A. | 硫化铵 | B. | 亚硫酸氢钾 | C. | 碳酸氢钠 | D. | 硫酸氢铵 |
11.下列物质都具有漂白作用,其中漂白原理没有利用物质化学性质的是( )
| A. | 过氧化钠 | B. | 二氧化硫 | C. | 双氧水 | D. | 活性炭 |
8.利用电负性数值可以预测( )
| A. | 分子的极性 | B. | 分子的对称性 | C. | 分子的空间构型 | D. | 化学键的极性 |
 CH3COOCH2CH3+H2O,该反应类型为酯化反应(取代反应).
CH3COOCH2CH3+H2O,该反应类型为酯化反应(取代反应).