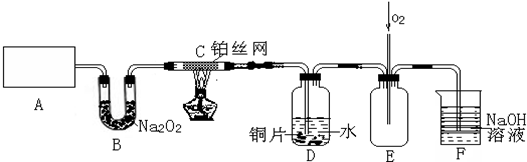
题目内容
5.以铬铁矿(主要成分是FeO•Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取Na2CrO4晶体的工艺流程如下: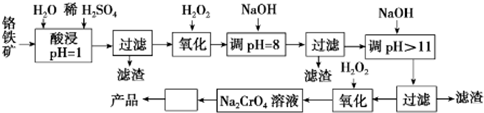
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO${\;}_{2}^{-}$形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
(2)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?不能,当pH=8时Al3+已经完全转化为Al(OH)3,若不经过滤除去,当继续加入NaOH时Al(OH)3会溶解,引入杂质离子AlO2-.
(3)流程图中从Na2CrO4溶液至产品中间“□”内的操作是蒸发浓缩、冷却结晶.
(4)CrO42-在酸性条件下转化为Cr2O72-.工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72-转化为Cr3+,该反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,再调节溶液的pH=9,使金属离子生成沉淀而除去.
分析 铬铁矿用稀硫酸酸浸,FeO、Cr2O3、MgCO3、Al2O3与硫酸反应加入溶液,而SiO2不反应,过滤除去SiO2.用H2O2将Fe2+氧化为Fe3+,再调节pH=8时,Fe3+、Al3+完全沉淀,过滤得到滤渣为Al(OH)3和Fe(OH)3,再调节pH=11,Mg2+完全沉淀被除去且Cr元素以CrO2-的形式存在,过滤后,向滤液中再加入过氧化氢,将CrO2-氧化为CrO42-,最后采取蒸发浓缩、冷却结晶的方法得到Na2CrO4晶体,
(1)第一次加入H2O2是为了将Fe2+氧化为Fe3+,第二次加入H2O2是为了将CrO2-氧化为CrO42-;
(2)“调pH=8”时沉淀成分是Al(OH)3和Fe(OH)3,如果不把前者除去,当继续加入NaOH至pH=11时,Al(OH)3会溶解,引入杂质离子AlO2-;
(3)Na2CrO4溶液得到Na2CrO4晶体,可以采取蒸发浓缩、冷却结晶的方法;
(4)在酸性条件下,Fe2+与Cr2O72-反应生成Cr3+和Fe3+,再根据题中提供的阳离子以氢氧化物形式沉淀时溶液的pH可知,调节pH使金属离子生成沉淀而除去.
解答 解:铬铁矿用稀硫酸酸浸,FeO、Cr2O3、MgCO3、Al2O3与硫酸反应加入溶液,而SiO2不反应,过滤除去SiO2.用H2O2将Fe2+氧化为Fe3+,再调节pH=8时,Fe3+、Al3+完全沉淀,过滤得到滤渣为Al(OH)3和Fe(OH)3,再调节pH=11,Mg2+完全沉淀被除去且Cr元素以CrO2-的形式存在,过滤后,向滤液中再加入过氧化氢,将CrO2-氧化为CrO42-,最后采取蒸发浓缩、冷却结晶的方法得到Na2CrO4晶体,
(1)第一次加入H2O2是为了将Fe2+氧化为Fe3+,反应离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O;第二次加入H2O2是为了将CrO2-氧化为CrO42-,反应离子方程式为:2CrO2-+3H2O2+2OH-═2CrO42-+4H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;2CrO2-+3H2O2+2OH-═2CrO42-+4H2O;
(2)“调pH=8”时沉淀成分是Al(OH)3和Fe(OH)3,如果不把前者除去,当继续加入NaOH至pH=11时,Al(OH)3会溶解,引入杂质离子AlO2-,
故答案为:不能,当pH=8时Al3+已经完全转化为Al(OH)3,若不经过滤除去,当继续加入NaOH时Al(OH)3会溶解,引入杂质离子AlO2-;
(3)Na2CrO4溶液得到Na2CrO4晶体,可以采取蒸发浓缩、冷却结晶的方法,
故答案为:蒸发浓缩、冷却结晶;
(4)在酸性条件下,Fe2+与Cr2O72-反应生成Cr3+和Fe3+,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,再根据题中提供的阳离子以氢氧化物形式沉淀时溶液的pH可知,调节pH=9时,溶液中的金属离子都生成沉淀而除去,
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;9.
点评 本题属于工艺流程制备题目,考查制备原理、实验方案评价、物质分离提纯、获取信息的能力,是对基础知识的综合考查,难度中等.

| A. | NH4+、Clˉ、CO32- | B. | Mg2+、NO3-、SO42- | ||
| C. | K+、Clˉ、HCO3- | D. | Na+、[Al(OH)4]ˉ、SO42- |
| A. | 任何一种微观粒子的摩尔质量以g/moL为单位时,其数值与该种粒子的相对分子(或原子)质量相同 | |
| B. | 物质的量是含有一定粒子数目的粒子的集合体 | |
| C. | 阿伏加德罗常数个微粒数就是12g12C原子所含的碳原子数 | |
| D. | 物质的量就是物质的质量 |
| A. | 1mol任何气体的体积一定是22.4L | |
| B. | 在标准状况下,体积为22.4L的物质都是1mol | |
| C. | 标准状况下,22.4L任何气体所含分子数都约为6.02×1023个 | |
| D. | 在常温时,1mol任何气体的体积不可能是22.4L |
| A. | 含氧元素的化合物都是氧化物 | B. | 含氢元素的化合物都是酸 | ||
| C. | 冰水混合物不是纯净物 | D. | 只含一种元素的物质不一定是单质 |
| A. | v(H2)=0.09 mol/(L•s) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.02 mol/(L•min) | D. | v(NH3)=0.03 mol/(L•s) |
| A. | 合理摄入维生素C能增强对传染病的抵抗力,而且它还有解毒作用 | |
| B. | 维生素D属于典型的水溶性维生素 | |
| C. | 为减少新鲜蔬菜中的维生素C的流失,炒蔬菜的时间不能太长,炒熟即可 | |
| D. | 补充维生素D有利于人体钙的摄入 |