题目内容
利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:

(1)实验目的:验证SO2的氧化性。将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,所产生的两种气体相遇发生反应:SO2+2H2S=3S+2H2O,则在支管交叉处实验现象为 ,硫化亚铁处加水的目的是 。
(2)实验目的:探究 SO2与BaCl2反应生成沉淀的条件。SO2通入BaCl2溶液并不产生沉淀,再通入另一种气体后就产生了白色沉淀。常温下,若由右侧 Y型管产生另一种气体,则在其左右支管应放置的药品是 和 ,导气管A的作用是 。
(3)实验目的:铁镁合金中铁含量的测定。①读取量气管中数据时,若发现水准管中的液面高于量气管中液面,应采取的措施是 ;②若称得铁镁合金的质量为 0.080g,量气管中初读数为1.00mL,末读数为 45.80mL(已折算为标准状况),则合金中铁的百分含量为 (精确到0.01%)。

(1)实验目的:验证SO2的氧化性。将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,所产生的两种气体相遇发生反应:SO2+2H2S=3S+2H2O,则在支管交叉处实验现象为 ,硫化亚铁处加水的目的是 。
(2)实验目的:探究 SO2与BaCl2反应生成沉淀的条件。SO2通入BaCl2溶液并不产生沉淀,再通入另一种气体后就产生了白色沉淀。常温下,若由右侧 Y型管产生另一种气体,则在其左右支管应放置的药品是 和 ,导气管A的作用是 。
(3)实验目的:铁镁合金中铁含量的测定。①读取量气管中数据时,若发现水准管中的液面高于量气管中液面,应采取的措施是 ;②若称得铁镁合金的质量为 0.080g,量气管中初读数为1.00mL,末读数为 45.80mL(已折算为标准状况),则合金中铁的百分含量为 (精确到0.01%)。
(17分)
(1)(共4分)管壁内有淡黄色固体生成(2分) 稀释浓硫酸,防止硫化氢被氧化(2分)
(2)(共6分)浓氨水、生石灰(或碱石灰、固体NaOH,4分) 保持集气瓶内外气压平衡(1分),以便左右两边产生的气体顺利导入(1分)
(3)(共7分)①放低(或移动)水准管位置(2分 ),使水准管、量气管内液面相平(2分) ②70.00%(3分)
(1)(共4分)管壁内有淡黄色固体生成(2分) 稀释浓硫酸,防止硫化氢被氧化(2分)
(2)(共6分)浓氨水、生石灰(或碱石灰、固体NaOH,4分) 保持集气瓶内外气压平衡(1分),以便左右两边产生的气体顺利导入(1分)
(3)(共7分)①放低(或移动)水准管位置(2分 ),使水准管、量气管内液面相平(2分) ②70.00%(3分)
试题分析:(1)依题意,二氧化硫气体与硫化氢气体反应生成单质硫和水,由此推断反应现象为管壁内有淡黄色固体生成、有液滴生成;由于硫化氢能被浓硫酸氧化,则硫化亚铁出加水的目的是稀释浓硫酸,防止稀硫酸与硫化亚铁反应放出的硫化氢气体被浓硫酸氧化;(2)根据二氧化硫的性质推断,右侧Y型管的作用是制取氨气,由于无加热仪器,则选择的试剂为浓氨水液体和生石灰或碱石灰或氢氧化钠固体,产生的氨气溶于BaCl2溶液,得到碱性溶液,再通入二氧化硫气体时,二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵与BaCl2溶液发生复分解反应,可以得到白色BaSO3沉淀和NH4Cl溶液;导管A的作用是保持集气瓶内外气压平衡,以便左右两边产生的气体顺利导入;(3)读数时,应放低(或移动)水准管位置,使水准管中的液面高于量气管中液面相平,以免造成误差;防止倒吸;设铁镁合金含有xmolFe、ymolMg,根据m=n?M,则①56x+24y=0.080;由于Fe+2HCl=FeCl2+H2↑、Mg+2HCl=MgCl2+H2↑中的系数之比等于物质的量之比,充分反应后得到氢气的物质的量为(x+y)mol;由于初末读数相差(45.80—1.00)mL=(45.80—1.00)×10—3L,说明充分反应后得到氢气的体积为(45.80—1.00)×10—3L;由于n=V/Vm,根据氢气的物质的量相等可得:②x+y =
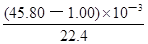 ;解①②可得:x=0.001,y=0.001,则合金中铁的质量为0.056g,镁为0.024g,所以合金中铁的质量分数为
;解①②可得:x=0.001,y=0.001,则合金中铁的质量为0.056g,镁为0.024g,所以合金中铁的质量分数为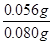 ×100%=70%。
×100%=70%。
练习册系列答案
相关题目
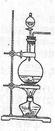

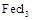 易升华。工业上制备无水的
易升华。工业上制备无水的
 Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。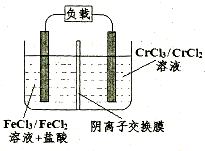
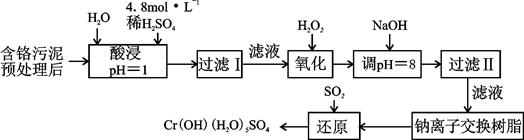
 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)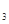 的溶度积Ksp= c(Cr3+)? c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
的溶度积Ksp= c(Cr3+)? c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。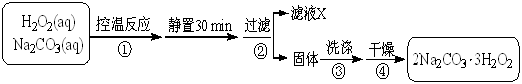
 2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0