题目内容
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示)。
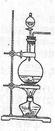
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是__________(填序号)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
制备反应会因盐酸浓度下降而停止。为测定已分离出过量MnO2后的反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:与已知量CaCO3(过量)反应,称量剩余固体的质量。
丙方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
(2)判定甲方案不可行,理由是______________________________________________________。
(3)乙方案的实验发现,固体中含有MnCO3,说明碳酸钙在水中存在__________________,测定的结果会:______________________(填“偏大”、“偏小”或“准确”)。
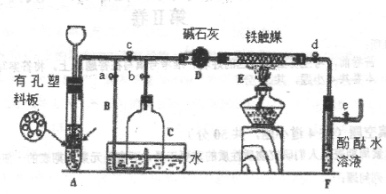
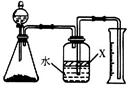
进行丙方案实验:装置如图所示(夹持器具已略去)。

(4)使Y形管中的残余清液与锌粒反应的正确操作是将________转移到______中。
(5)反应完毕,每间隔1分钟读取气体体积,发现气体体积逐渐减小,直至不变。 气体体积逐次减小的原因是____________(排除装置和实验操作的影响因素)。
(6)小组内又有同学提出还可采用酸碱中和滴定法测定残余液中盐酸的浓度,但还需经查阅资料知道:________________________________________________________ 。

(1)制备实验开始时,先检查装置气密性,接下来的操作依次是__________(填序号)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
制备反应会因盐酸浓度下降而停止。为测定已分离出过量MnO2后的反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:与已知量CaCO3(过量)反应,称量剩余固体的质量。
丙方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
(2)判定甲方案不可行,理由是______________________________________________________。
(3)乙方案的实验发现,固体中含有MnCO3,说明碳酸钙在水中存在__________________,测定的结果会:______________________(填“偏大”、“偏小”或“准确”)。
进行丙方案实验:装置如图所示(夹持器具已略去)。

(4)使Y形管中的残余清液与锌粒反应的正确操作是将________转移到______中。
(5)反应完毕,每间隔1分钟读取气体体积,发现气体体积逐渐减小,直至不变。 气体体积逐次减小的原因是____________(排除装置和实验操作的影响因素)。
(6)小组内又有同学提出还可采用酸碱中和滴定法测定残余液中盐酸的浓度,但还需经查阅资料知道:________________________________________________________ 。
(本题共12分,每小题2分) (1)ACB
(2)残余溶液中,只能计算出Cl-的量,而不能算出H+的量,且n(Cl-)>n(H+)
(3)溶解平衡,偏小;
(4)Zn粒;残余清液(按序写出两项)
(5)装置内气体尚未冷至室温
(6)Mn2+开始沉淀时的pH
(2)残余溶液中,只能计算出Cl-的量,而不能算出H+的量,且n(Cl-)>n(H+)
(3)溶解平衡,偏小;
(4)Zn粒;残余清液(按序写出两项)
(5)装置内气体尚未冷至室温
(6)Mn2+开始沉淀时的pH
试题分析:(1)加药顺序一般是先加入固体药品,再加入液药品,最后再加热。检查装置气密性后,先加入固体,再加入液体:浓盐酸,最后然后加热,因此依次顺序是ACB。
(2)由于加入足量的硝酸银溶液只能求出氯离子的量,而不能求出剩余盐酸的浓度,且n(Cl-)>n(H+),所以与足量AgNO3溶液反应,称量生成的AgCl质量方案是不可行的。
(3)由于碳酸钙在溶液中存在溶解平衡,固体中含有MnCO3,这说明碳酸锰的Ksp比碳酸钙的Ksp小。由于部分碳酸钙转化成碳酸锰沉淀,因此称量剩余的固体质量会偏大,这样一来反应的固体减少,实验结果偏小。
(4)使Zn粒进入残余清液中让其发生反应.这样残余清液就可以充分反应.如果反过来,残余清液不可能全部转移到左边,因此导致反应不完全。
(5)由于气体的体积受温度影响,所以反应完毕后,每间隔1分钟读取气体体积,气体体积逐渐减小的原因是气体未冷却到室温,当温度冷却到室温后,气体体积不再改变。
(6)采用酸碱中和滴定法测定残余液中盐酸的浓度,碱滴定溶液先和酸反应后再和氯化锰反应生成氢氧化锰沉淀,需要知道锰离子开始沉淀时的pH才能计算盐酸消耗的氢氧化钠,从而计算剩余盐酸的量。

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目


 。
。