题目内容
氨化铁是常见的水处理剂,无水晶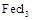 易升华。工业上制备无水的
易升华。工业上制备无水的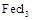 的一种工艺如图所示:
的一种工艺如图所示:
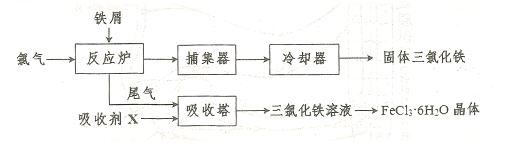
(1)加入吸收塔的吸收剂X应是 (填字母编号)。
a.NaOH溶液 b.饱和食盐水 c.FeCl2溶液 d.淀粉KI溶液
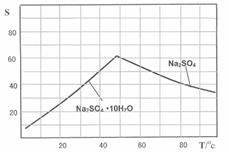
(2)取0.5mL饱和FeCl3溶液滴入50mL沸水中,得红褐色氢氧化铁胶体,则发生反应的离子方程式为 ,胶体粒子的直径一般不超过 。
(3)实验室中从FeCl3溶液制得FeCl3·6H2O晶体的过程中,需先加入 且保持过量,然后进行的操作依次为 、冷却结晶、过滤。
(4)将H2S气体通入FeCl3溶液中会出现浑浊,则其反应的离子方程式为 。
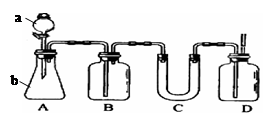
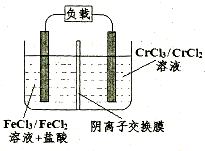
(5)铁铬氯化还原液流电池是一种低成本的储能电池,电池结构如图所示(电极材料为石墨),工作原理为:Fe3++Cr2+ Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
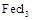 易升华。工业上制备无水的
易升华。工业上制备无水的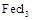 的一种工艺如图所示:
的一种工艺如图所示:
(1)加入吸收塔的吸收剂X应是 (填字母编号)。
a.NaOH溶液 b.饱和食盐水 c.FeCl2溶液 d.淀粉KI溶液
(2)取0.5mL饱和FeCl3溶液滴入50mL沸水中,得红褐色氢氧化铁胶体,则发生反应的离子方程式为 ,胶体粒子的直径一般不超过 。
(3)实验室中从FeCl3溶液制得FeCl3·6H2O晶体的过程中,需先加入 且保持过量,然后进行的操作依次为 、冷却结晶、过滤。
(4)将H2S气体通入FeCl3溶液中会出现浑浊,则其反应的离子方程式为 。
(5)铁铬氯化还原液流电池是一种低成本的储能电池,电池结构如图所示(电极材料为石墨),工作原理为:Fe3++Cr2+
 Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
Fe2++Cr3+,则电池放电时,Cl-将移向 极(填“正”或“负”);充电时,阴极的电极反应式为 。
(1)c(2分)
(2)Fe3++3H2O Fe(OH)3(胶体) +3H+ (2分) 100nm(1分)
(3)盐酸 (2分) 蒸发浓缩(或加热蒸发)(2分)
(4)H2S+ 2Fe3+= 2Fe2++ S↓+2H+ (2分)
(5)负 (1分) Cr3++e-= Cr2+(2分)
试题分析:(1)通过工业上制备无水FeCl3的工艺流程图可知,从反应炉中排出的尾气是反应剩余的Cl2,与吸收剂X在吸收塔中反应生成FeCl3溶液,则吸收剂X应是FeCl2溶液。(3)从FeCl3溶液制得FeCl3·6H2O晶体的过程中,为抑制Fe3+的水解,需先加入盐酸且保持过量,然后依次进行蒸发浓缩、冷却结晶、过滤等操作。(4)H2S气体通入FeCl3溶液中,Fe3+将H2S氧化为S,Fe3+被还原为Fe2+。(5)电池工作时,电解质溶液中的阴离子移向负极,则铁铬氧化还原液流电池放电时,Cl-将移向负极;充电时,阴极发生还原反应,Cr3+得电子生成Cr2+。 3流程为切入点考查胶体、盐的水解、实验基本操作、Fe3+的氧化性、电化学的相关知识,同时考查学生的分析问题和解决问题能力。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
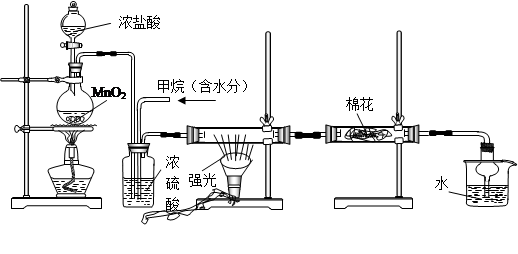
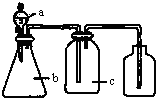
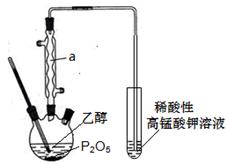

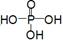 )__________________________________。
)__________________________________。