题目内容
【题目】室温下,将0.1 mol/L NaOH溶液滴入20.00 mL 0.1 mol/L HA溶液,溶液pH随加入NaOH溶液体积的变化曲线如图所示。
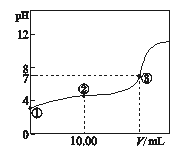
其中不正确的是 ( )
A. ①点:由水电离出的c(H+)=1×10-3mol/L
B. ②点:c(A-)>c(Na+)>c(H+)>c(OH-)
C. ③点:c(Na+)=c(A-)>c(H+)=c(OH-)
D. ③点加入NaOH溶液的体积小于20.00mL
【答案】A
【解析】A. ①点时溶液中H+为HA电离出,A错误;B. ②点,c(Na+)=0.05mol/L,c(H+)=1×10-4mol/L,c(OH-)=1×10-10mol/L,B正确;C. ③点,NaOH与参与电解的HA完全中和,则c(Na+)=c(A-)且c(H+)=c(OH-)=1×10-7mol/L,所以C正确;D. HA为弱电解质,不能完全电离,故参与反应的NaOH溶液的体积小于20.00mL,D正确。故选择A。

练习册系列答案
相关题目