题目内容
【题目】图1是元素周期表的一部分,A、B、C、D、E、X 是元素周期表给出元素组成的常见单质或化合物.已知 A、B、C、D、E、X 存在如图2所示转化关系(部分生成物和反应条件略去). 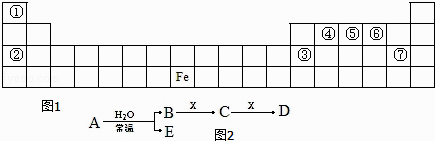
(1)若 E 为氧化物,则 A 与水反应的方程式为 , 该反应中氧化剂和还原剂物的量之比为 . ①当 X 为碱性盐溶液,C分子中有 22 个电子时,D 是(写化学式).
②当 X 为金属单质时,X 与足量 B 的稀溶液反应生成 C 的离子方程式为 , 写出检验生成物 C 的阳离子所用试剂的电子式 .
(2)若 E 为单质气体,D 为白色沉淀,A 可能是(写化学式),X是(写化学式).
【答案】
(1)3NO2+H2O═2HNO3+NO;1:2;NaHCO3;Fe+4H++NO3﹣═Fe3++NO↑+2H2O;![]()
(2)Na、Na2O2等;AlCl3或Al(NO3)3
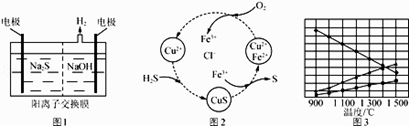
【解析】解:由元素在周期表中的位置可知,①为H元素,②为Na元素,④为C元素,⑤为N元素,⑥为O元素,③为Al,⑦为Cl元素.(1)若E为氧化物,根据转化关系以及元素种类可知,则A为NO2 , B为硝酸,NO2与水反应生成硝酸和一氧化氮,其反应为3NO2+H2O═2HNO3+NO.该反应中氧化剂是NO2 , 还原剂是NO2 , 氧化剂与还原剂的物质的量之比为1:2, 所以答案是:3NO2+H2O═2HNO3+NO;1:2;
①C 分子中有 22 个电子时,C为二氧化碳,X为碳酸盐,硝酸与碳酸盐反应生成二氧化碳,CO32﹣离子水解CO32﹣+H2OHCO3﹣+OH﹣使X液呈碱性,二氧化碳与碳酸钠反应生成D为NaHCO3 ,
所以答案是:NaHCO3;②X为金属单质时,由转化图可知,应为Fe与稀硝酸反应生成硝酸铁,X与B的稀溶液反应生成C的离子方程式为Fe+4H++NO3﹣═Fe3++NO↑+2H2O,检验生成物 C 的阳离子所用试剂为KSCN,电子式为 ![]() ,
,
所以答案是:Fe+4H++NO3﹣═Fe3++NO↑+2H2O; ![]() ;(2)由转化关系以及元素种类,若E为单质气体,则E为氢气或氧气,A为Na或Na2O2等,B为NaOH,D为白色沉淀,D为Al(OH)3 , 由B
;(2)由转化关系以及元素种类,若E为单质气体,则E为氢气或氧气,A为Na或Na2O2等,B为NaOH,D为白色沉淀,D为Al(OH)3 , 由B ![]() C
C ![]() D,可以推知X为铝盐[AlCl3 或 Al(NO3)3],C为偏铝酸盐,C与X反应的离子反应为3AlO2﹣+Al3++6H2O═4Al(OH)3↓,
D,可以推知X为铝盐[AlCl3 或 Al(NO3)3],C为偏铝酸盐,C与X反应的离子反应为3AlO2﹣+Al3++6H2O═4Al(OH)3↓,
所以答案是:Na、Na2O2等;AlCl3 或 Al(NO3)3 .

 阅读快车系列答案
阅读快车系列答案【题目】下列项目判断,结论正确的是( )
选项 | 项目 | 结论 |
A | 三种有机化合物:乙烷、氯乙烯、苯 | 分子内所有原子均在同一平面上 |
B | C4H8Cl2的同分异构体数目(不考虑立体异构) | 共有10种 |
C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
D | 由乙酸和乙醇制乙酸乙酯,油脂水解 | 均属于取代反应 |
A.A
B.B
C.C
D.D