题目内容
【题目】甲醇是重要的绿色能源之一,目前科学家用水煤气(CO+H2)合成甲醇,其反应为:CO(g)+2H2(g) ![]() CH3OH(g),△H=﹣128.1kJmol﹣1 , 回答下列问题:
CH3OH(g),△H=﹣128.1kJmol﹣1 , 回答下列问题:
(1)该反应是可逆反应,为使化学反应速率和CO的转化率都同时提高的措施有(写两条).
(2)恒温恒容条件能说明该可逆反应达平衡的是;
A.2v正(H2)=v逆(CH3OH)
B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
(3)若上述可逆反应在恒温恒容的密闭容器进行,起始时间向该容器中冲入1molCO(g)和2molH2(g).实验测得H2的平衡转化率随温度(T)、压强(P)的变化如图所示.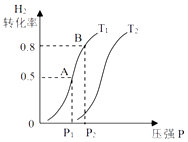
①该反应的△S0,图中的T1T2(填“<”“>”或“=”)
②T1下到达平衡状态A时,容器的体积为2L,此时该反应的平衡常数为 , 若达到平衡状态B时,则容器的体积V(B)=L.
(4)已知:H2(g)燃烧热△H=﹣285.8KJmol﹣1、和CO(g)燃烧热△H=﹣283.0KJmol﹣1 , 则CH3OH(g)燃烧热的热化学方程式是为 .
【答案】
(1)增大压强、增加氢气的物质的量
(2)D
(3)<,<,4L2/mol2,0.4
(4)![]() △H=﹣726.5kJ/mol
△H=﹣726.5kJ/mol
【解析】解:(1)该反应式可逆反应,随着反应的进行,气体分子总数减小,体系压强减小,反应焓变<0,表明反应是放热反应,为了使化学反应速率和CO的转化率同时提高,根据勒夏特列原理,可以考虑采取的措施有增大压强,增加氢气的物质的量.所以答案是:增大压强、增加氢气的物质的量.(2)恒温恒容条件下,常用判断化学反应达到平衡的判据有正逆反应速率,热量变化情况,体系有气体参与时的压强变化等.
A.能判定化学反应达到平衡的速率关系应为v正(H2)=2v逆(CH3OH),故A错误;
B.当反应物按照化学计量比1:2反应,到达平衡时,各组分的物质的量之比需视具体的转化率而定,n(CO):n(H2):n(CH3OH)=1:2:1不可作为判据,故B错误;
C.混合气体的密度为 ![]() ,在恒温恒容密闭体系中,根据质量守恒定律,m混是不变的,整个反应过程混合气体的密度是不变的,不可作为判据,股C错误;
,在恒温恒容密闭体系中,根据质量守恒定律,m混是不变的,整个反应过程混合气体的密度是不变的,不可作为判据,股C错误;
D.混合气体的平均相对分子质量为 ![]() ,由于化学反应前后,气体的物质的量在改变,则混合气体的平均相对分子质量随着反应的进行将发生改变直到反应达到平衡,可以作为判据,故D正确.
,由于化学反应前后,气体的物质的量在改变,则混合气体的平均相对分子质量随着反应的进行将发生改变直到反应达到平衡,可以作为判据,故D正确.
故选D.(3)①反应在恒温恒容密闭容器中进行,起始时向容器中冲入1molCO(g)和2molH2(g),实验测得H2的平衡转化率随温度(T)和压强(p)的变化有图,根据图象,随着该反应的进行,体系总压强减小,气体分子数减小,反应是熵减的反应,即体系的混乱度减小,故△S<0;控制压强不变,发现T1温度下的H2转化率更高,结合反应是放热的反应(△H<0)可知,温度减小有利于反应物的转化率提高,故T1<T2.所以答案是:<,<.
②T1下达平衡状态A时,根据图象可知,此时体系压强为p1,H2转化率为0.5,已知容器的体积为2L,则平衡时,根据反应方程式:CO(g)+2H2(g)CH3OH(g),由于氢气的转化率为0.5,则氢气转化了△n(H2)=2mol×0.5=1mol,则CO转化了△n(CO)=0.5mol,生成了CH3OH为△n(CH3OH)=0.5mol,因此平衡时 ![]() ,
, ![]() ,
, ![]() ,根据平衡常数的表达式
,根据平衡常数的表达式 ![]() =
= ![]() =4L2/mol2.
=4L2/mol2.
当反应达到平衡状态B时,根据图象,此时压强为p2,氢气的转化率为0.8,此时氢气转化了△n(H2)=2mol×0.8=1.6mol,根据反应方程式,CO转化了△n(CO)=0.8mol,生成了CH3OH为△n(CH3OH)=0.8mol,设此时容器体积为VL,则平衡时 ![]() mol/L,
mol/L, ![]() mol/L,
mol/L, ![]() mol/L,B状态温度也为T1,反应平衡常数仍为K=4L2/mol2,则
mol/L,B状态温度也为T1,反应平衡常数仍为K=4L2/mol2,则 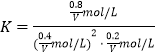 =4L2/mol2,解得V(B)=0.4L.
=4L2/mol2,解得V(B)=0.4L.
所以答案是4L2/mol2,0.4.(4)反应的焓变=反应物的总燃烧热﹣生成物的总燃烧热,已知H2的燃烧热为△H(H2)=﹣285.8kJ/mol,CO的燃烧热为△H(CO)=﹣283.0kJ/mol,反应CO(g)+2H2(g)=CH3OH(g),该反应的焓变为△H=△H(CO)+2△H(H2)﹣△H(CH3OH,g)=﹣128.1kJ/mol,解得△H(CH3OH,g)=﹣726.5kJ/mol,则CH3OH(g)的燃烧热的热化学方程式为: ![]() ═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol.
═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol.
所以答案是: ![]() ═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol.
═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol.
【考点精析】利用化学平衡状态本质及特征和化学平衡状态的判断对题目进行判断即可得到答案,需要熟知化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.

【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

(A为具有支管的试管,在其下端开了一个小孔。塞好石棉绒。再加入少量铁屑粉)
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水溶性 | 微溶 | 微溶 | 微溶 |
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中有机物发生的反应方程式(有机物写结构简式):______________________,反应类型为______________。
(2)反应开始后,可观察到D中溶液变红,E中出现__________________,试管C中苯的作用是__________。用相关化学用语解释D中溶液变红的原因________________。
(3)反应2~3min后,在B中可观察到在溶液中出现红色絮状沉淀、底部有油状液体。生成红色絮状沉淀的离子方程式为_______________________________。
(4)向B中分离出的油状液体加入少量无水氯化钙,静置、过滤。加入氯化钙的目的是________________。
(5)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必需的是______(填入正确选项前的字母)。
A.蒸发 B.过滤 C.蒸馏 D.萃取
(6)在A~F中,具有防倒吸作用的有_________(填字母)。
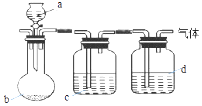
【题目】用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )
气体 | a | b | c | d | |
A | CO2 | 稀硫酸 | 石灰石 | 饱和Na2CO3溶液 | 浓H2SO4 |
B | Cl2 | 浓盐酸 | KMnO4固体 | 饱和NaCl溶液 | 浓H2SO4 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 碱石灰 |
D | H2 | 硝酸 | 锌粒 | H2O | P2O5 |
A.A
B.B
C.C
D.D