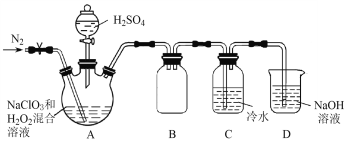
题目内容
【题目】用下图甲所示装置电解饱和食盐水制Cl2、H2和NaOH。
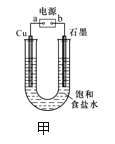
(1)b为电源的______极,Cu极的电极反应式为________。
(2)某同学在进行上述实验时,发现铜电极下方产生红色沉淀,石墨电极上产生无色无味的气体,则该同学将石墨连接到了电源的______极。
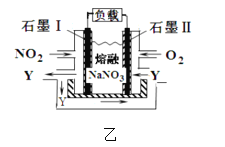
(3)电解粗铜制精铜时,可采用NO2、O2和熔融NaNO3制作的燃料电池作电源,其原理如图,该电池在使用过程中石墨 I电极上生成氧化物Y,则其正极的电极反应为:__________。
【答案】正 2H++2e-=H2 ↑ 负 O2+4e-+2N2O5=4NO3-
【解析】
根据电解池原理分析电解饱和食盐水时所用电极及对应的电极反应;根据燃料电池原理书写电极反应式。
(1)用惰性电极电解饱和食盐水时,在阳极上产生氯气,在阴极上产生氢气和氢氧化钠,此时阳极是惰性电极,即b为电源的正极,Cu作阴极,发生还原反应,电极反应式为: 2H++2e-=H2 ↑;
(2)发现铜电极下方产生红色沉淀,则金属铜是阳极,a为电源的正极,石墨连接到了电源的负极,阳极的电极反应式为:2OH-+2Cu-2e-=Cu2O↓+H2O,故答案为负极;
(3)根据燃料电池的构造得总反应为4NO2 + O2 = 2N2O5,氧化物Y为N2O5,正极得电子,发生还原反应,则电极反应为:O2+4e-+2N2O5=4NO3-。

练习册系列答案
相关题目