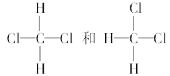题目内容
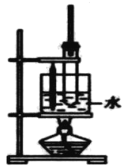
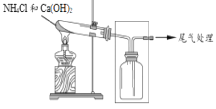
【题目】某小组同学用图所示装置制取氨,并探究其性质。
(1)制取氨气的化学方程式是______。
(2)采用图示的方法收集氨气,是因为氨气的密度比空气 ______(填“大”或“小”)。
(3)将蘸有浓盐酸的棉球放在玻璃片上,用集满NH3的集气瓶扣住棉球,可观察到的现象是______。
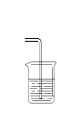
(4)甲同学设计了下图所示的装置进行尾气处理,乙同学认为该设计不合理,请画出正确的尾气吸收图______。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 小 产生白烟
CaCl2+2NH3↑+2H2O 小 产生白烟 
【解析】
(1)实验室制备氨气是利用氯化铵与氢氧化钙固体加热反应制得;
(2)采用向下排空气法,是因为氨气的密度比空气小;
(3)氯化氢气体和氨气接触能产生白烟氯化铵;
(4)氨气易溶于水,尾气处理时需要防倒吸。
(1) 实验室制备氨气是加热氯化铵与氢氧化钙固体,反应方程式:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)图示收集氨气的方法是向下排空气法,是因为氨气的密度比空气小,故答案为:小;
(3)氯化氢气体和氨气接触能产生氯化铵,是固体小颗粒,可观察到的现象是:产生白烟;
(4)因为氨气极易溶于水,尾气处理氨气时,应添加防倒吸装置,可用长颈漏斗倒扣水面制成,画图为: 。
。

【题目】研究煤的合理利用及 CO2的综合应用有着重要的意义。请回答以下问题:
I.煤的气化
已知煤的气化过程涉及的基本化学反应有:
①C(s)+H2O(g) ![]() CO(g)+H2(g) △H=+131kJ·mol-1
CO(g)+H2(g) △H=+131kJ·mol-1
②CO(g)+3H2(g) ![]() CH4(g) +H2O(g) △H=akJ·mol-1
CH4(g) +H2O(g) △H=akJ·mol-1
查阅资料反应②中相关化学键能数据如下表:
化学键 | C≡O | H—H | H—C | H—O |
E(kJ·mol-1) | 1072 | 436 | 414 | 465 |
(1)则反应②中 a =_____________。
(2)煤直接甲烷化反应 C(s) + 2 H2 (g) ![]() CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
II.合成低碳烯烃
在体积为1 L 的 密闭容器中,充入 1mol CO2和 2 .5 mol H2, 发生 反应: 2CO2 ( g) + 6 H2(g)![]() C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
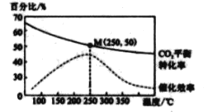
(3) 图中低温时, 随着温度升高催化剂的催化效率提高, 但 CO2的平衡转化率却反而降低 ,其原因是_______________.
(4) 250℃时,该反应的平衡常数K 值为____________。
III.合成甲醇
在恒温 2 L 容积不变的密闭容器中,充入 1molCO2 和 3 molH2, 发生反应:. CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5) 反应前 1 小时内的平均反应速率 v(H2)为_______molL-1h-1 , 该温度下CO2的平衡转化率为_____________。