题目内容
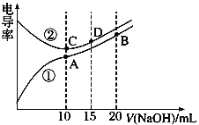
【题目】如图表示用酸性氢氧燃料电池为电源进行的电解实验。下列说法中正确的是( )
A. 燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,a极上产生的O2与电池中消耗的 H2体积比为 ![]()
【答案】C
【解析】原电池中负极发生失去电子的氧化反应,正极发生得到电子的还原反应,氢气在负极通入,氧气在正极通入,据此解答。
A. 燃料电池工作时,通入氧气的电极为正极,由于电解质溶液为酸性,所以正极反应为:O2+4H++4e-=2H2O,A错误;
B. a极是铁,与电源的正极连接,是阳极,属于活性电极,发生反应:Fe-2e-=Fe2+;b极是铜,与电源的负极连接为阴极,发生反应:Cu2++2e-=Cu,所以a极逐渐溶解,b极质量增加,B错误;
C. a极是粗铜,b极是纯铜时,a极发生的电极反应是:Cu-2e-=Cu2+;逐渐溶解,b极上发生的电极反应是:Cu2++2e-=Cu,有铜析出,C正确;
D. a、b两极均是石墨时,在相同条件下,a极发生反应:4OH--4e-=2H2O+O2↑,电池的负极发生的反应是:2H2-4e-=4H+,根据在闭合回路中电子转移数目相等可知,a极产生的气体是电池中消耗的H2体积的一半,D错误。
答案选C。

【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D