题目内容
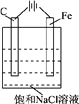
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质(Li+可自由通过),用该电池为电源电解含镍酸性废水并得到单质Ni,实验装置如图所示。下列说法正确的是( )
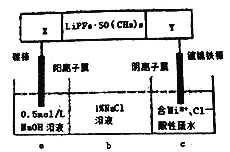
A. 电极X应为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式不发生改变
【答案】C
【解析】由于c中反应为Ni2++2e-![]() Ni,故c室为阴极室,则电极Y为Li,选项错误;由于c中Ni2+不断减少,Cl-通过阴离子膜从c移向b,a中OH-放电不断减少,Na+通过阳离子膜从a移向b,所以b中NaCl溶液的物质的量浓度不断增大,选项B错误;选项C中电极X为正极,FeS得电子,电极反应式为FeS+2Li++2e-
Ni,故c室为阴极室,则电极Y为Li,选项错误;由于c中Ni2+不断减少,Cl-通过阴离子膜从c移向b,a中OH-放电不断减少,Na+通过阳离子膜从a移向b,所以b中NaCl溶液的物质的量浓度不断增大,选项B错误;选项C中电极X为正极,FeS得电子,电极反应式为FeS+2Li++2e-![]() Fe+Li2S,选项C正确;若去掉阳离子膜,Cl-在阳极放电生成Cl2,电解反应总方程式发生改变,选项D正确。
Fe+Li2S,选项C正确;若去掉阳离子膜,Cl-在阳极放电生成Cl2,电解反应总方程式发生改变,选项D正确。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】原子序数由小到大排列的四种短周期元素 X、Y、Z、W,四种元素的原子序数之和为 32,在周期表中 X 是原子半径最小的元素,Y、Z 左右相邻,Z、W 位于同主族。
(1)W 原子的核外电子排布式为__________________。
(2)均由 X、Y、Z 三种元素组成的三种常见物质 A.、B、C 分别属于酸、碱、盐,其化学式依次 为________________ 、__________________ 、____________________,推测盐中阴离子的空间构型为___________ ,其中心原子杂化方式为_________________________。
(3)Z、W 两种元素电负性的大小关系为___________ (填“大于”“等于”或“小于”);Y、Z 两种元素第 一电离能的大小关系为________________ (填“大于”“等于”或“小于”)。
(4)CO 的结构可表示为C≡O,元素Y 的单质Y2 的结构也可表示为Y≡Y。下表是两者的键能数据(单位:kJmol1):
AB | A═B | A≡B | |
CO | 357.7 | 798.9 | 1071.9 |
Y2 | 154.8 | 418.4 | 941.7 |
①结合数据说明 CO 比 Y2 活泼的原因:_________________________。
②意大利罗马大学 FulvioCacace 等人获得了极具研究意义的 Y4 分子,其结构如图所示,请结合上表数 据分析,下列说法中,正确的是_____。
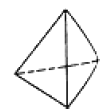
a. Y4 为一种新型化合物
b. Y4 与 Y2 互为同素异形体
c. Y4 的沸点比 P4(白磷)高
d. 1mol Y4 气体转变为 Y2 将放出 954.6kJ 热量
【题目】金属铬(Cr)的本意是颜色,因为它的化合物或离子都有美丽的颜色。下表是几种常见含铬的离子水溶液的颜色:
离子 | Cr2O72- | Cr(OH)4 | Cr3+ | CrO42- | Cr2+ |
颜色 | 橙色 | 绿色 | 蓝紫色 | 黄色 | 蓝色 |
(1)铬铁矿的主要成分是Fe(CrO2)2,该物质中三种元素的化合价均为整数,则Cr的化合价是_____________。
(2)向Na2CrO4溶液中加入浓盐酸,溶液会变为蓝紫色并有黄绿色气体产生,则氧化剂和还原剂的物质的量之比为_____________。
(3)向Na2Cr2O7溶液中加入浓NaOH溶液,会变成黄色,请解释原因(用离子方程式和必要的文字说明)_____________________________________________。
(4)工业上以铬铁矿[主要成分为Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料,生产重铬酸钠晶体(Na2Cr2O7·2H2O)。主要工艺流程如下:
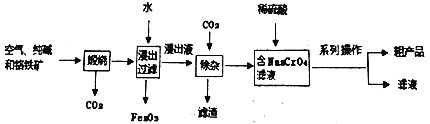
①滤渣的成分是_____________(写化学式)
②写出煅烧过程中,所发生的非氧化还原反应的化学方程式(任写一个)______________________。
③煅烧过程中,所发生的氧化还原反应如下:(其中浸出液显黄色),请完成下面化学方程式并配平。
□Fe(CrO2)2+□Na2CO3+□O2=□_________+□Fe2O3+□CO2
④工业上在重铬酸钠溶液中加入适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为__________________。