题目内容
【题目】原子序数由小到大排列的四种短周期元素 X、Y、Z、W,四种元素的原子序数之和为 32,在周期表中 X 是原子半径最小的元素,Y、Z 左右相邻,Z、W 位于同主族。
(1)W 原子的核外电子排布式为__________________。
(2)均由 X、Y、Z 三种元素组成的三种常见物质 A.、B、C 分别属于酸、碱、盐,其化学式依次 为________________ 、__________________ 、____________________,推测盐中阴离子的空间构型为___________ ,其中心原子杂化方式为_________________________。
(3)Z、W 两种元素电负性的大小关系为___________ (填“大于”“等于”或“小于”);Y、Z 两种元素第 一电离能的大小关系为________________ (填“大于”“等于”或“小于”)。
(4)CO 的结构可表示为C≡O,元素Y 的单质Y2 的结构也可表示为Y≡Y。下表是两者的键能数据(单位:kJmol1):
AB | A═B | A≡B | |
CO | 357.7 | 798.9 | 1071.9 |
Y2 | 154.8 | 418.4 | 941.7 |
①结合数据说明 CO 比 Y2 活泼的原因:_________________________。
②意大利罗马大学 FulvioCacace 等人获得了极具研究意义的 Y4 分子,其结构如图所示,请结合上表数 据分析,下列说法中,正确的是_____。
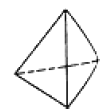
a. Y4 为一种新型化合物
b. Y4 与 Y2 互为同素异形体
c. Y4 的沸点比 P4(白磷)高
d. 1mol Y4 气体转变为 Y2 将放出 954.6kJ 热量
【答案】 1s22s22p63s23p4 HNO3 NH3H2O NH4NO3 平面三角形 sp2 大于 大于 CO 的第一个π 键的键能为273kJ/mol,N2 中的第一个π 键的键能为523.3kJ/mol,所以CO 的第一个键比N2 更容易断裂 bd
【解析】原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,则X是H元素,Y、Z左右相邻,Z、W位于同主族,设Y的原子序数是a,则Z的原子序数是a+1、W原子序数是a+9,a+a+1+a+9+1=32,则a=7,所以Y是N、Z是O、W是S元素。
(1)W是S元素,其原子核外有16个电子,根据构造原理知其基态原子核外电子排布式为1s22s22p63s23p4,故答案为:1s22s22p63s23p4;
(2)均由H、N、O三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,酸是硝酸、碱是一水合氨、盐是硝酸铵,盐的化学式为NH4NO3,硝酸根离子价层电子对个数=3+![]() (5+1-3×2)=3且不含孤电子对,所以硝酸根离子空间结构为平面三角形,N原子杂化方式为sp2,故答案为:HNO3;NH3H2O;NH4NO3;平面三角形;sp2;
(5+1-3×2)=3且不含孤电子对,所以硝酸根离子空间结构为平面三角形,N原子杂化方式为sp2,故答案为:HNO3;NH3H2O;NH4NO3;平面三角形;sp2;
(3)同一主族元素中,元素的电负性随着原子序数的增大而减小,所以电负性O>S;同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以第一电离能N>O,故答案为:大于;大于;
(4)①根据表中数据可知,断裂C≡O中的一个π键消耗的能量是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,断裂N≡N中的一个π键消耗的能量是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼,故答案为:CO的第一个π键的键能为273kJ/mol,N2中的第一个π键的键能为523.3kJ/mol,所以CO的第一个键比N2更容易断裂;
②a.N4为单质不是化合物,故a错误;b.N4与N2为同种元素的不同导致,互为同素异形体,故b正确;c.N4和P4都是分子晶体,并且结构相似,相对分子质量越大,分子间作用力越强,沸点越高,所以白磷的沸点高,故c错误;D.1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂吸收的热量为6×154.8kJ=928.8kJ,形成化学键放出的热量为941.7kJ×2=1883.4kJ,所以1mo1N4气体转变为N2将放热,则放出的热量=1883.4kJ-928.8kJ=954.6kJ,故D正确;故选bd。

 步步高达标卷系列答案
步步高达标卷系列答案